లోహాలు
లోహముల లక్షణాలు
[మార్చు]మానవుడు సాంకేతికంగా అభివృద్ధి చెందే ప్రయాణంలో లోహములు (metals) కీలకమైన పాత్ర వహించేయనడంలో సందేహం లేదు. అందుచేత చాల మందికి లోహములంటే ఏమిటో, వాటి గుణగణాలు ఏమిటో అనుభవపూర్వకంగా తెలిసే ఉంటుంది. సర్వసాధారణంగా లోహాలకి ఉండే లక్షణాలు: వాటికి ఒక రకమైన "మెరుపు" లేదా "తళుకు" (lustre) ఉంటుంది; లేకపోతే మెరుగు పెట్టి మెరుపు తెప్పించవచ్చు. (2) అవి ముట్టుకుంటే చేతికి చల్లగా తగులుతాయి. (3) అవి త్వరగా వేడెక్కుతాయి లేదా, వాటి ఉష్ణ వాహకత (heat conductivity) ఎక్కువ. (4) వాటి విద్యుత్ వాహకత (electrical conductivity) కూడా ఎక్కువే! (5) ఈ వస్తువులని సుత్తితో కొడితే ఖంగు మని మోగుతాయి. (6) ఒంచితే ఒంగుతాయి, సాగదీస్తే తీగలా సాగుతాయి. ఈ లక్షణాన్ని "తాంతవత" (ductility) అంటారు. (7) సుత్తితో బాదితే పలచబడి గట్టిబడతాయి. ఈ లక్షణాన్ని "అఘాత వర్ధనీయత" (malleability) అంటారు. (8) ఇవి సర్వసాధారణంగా బరువుగా ఉంటాయి. (9) ఇవి వేడి చేస్తే కరుగుతాయి. ఇలా ఈ జాబితాని పొడిగించుకుంటూ పోవచ్చు.
అన్ని లోహాలూ, అన్ని వేళలలోనూ ఈ లక్షణాలన్నిటిని ప్రదర్శించక పోవచ్చు. అలాగే ఈ లక్షణాలు ఉన్నంత మాత్రాన అవి లోహాలవాలని నియమం ఏమీ లేదు. ఉదాహరణకి గాజుని గోటితో మీటితే టింగు మని శబ్దం చేస్తుంది కదా; గాజు (glass) లోహం కాదని అందరికీ చెప్పకనే తెలుసు! సీసం (lead), తగరం (tin) లోహాలయినప్పటికీ అవి టింగు మనవు, ఖంగు మనవు. పోత ఇనుము (cast iron) పెళుసుగా ఉంటుంది. అల్లూమినం (aluminum), మగ్నం (magnesium) తక్కువ సాంద్రత కలవి కనుక తేలికగా ఉంటాయి. గ్రేఫైట్ (graphie) కి - లోహం కాకపోయినా - వాహక శక్తి ఎక్కువ అవడమే కాకుండా మెరుగు పెట్టి తళుకు తెప్పించవచ్చు. ఇలా మినహాయింపులు చెప్పుకుంటూ పోతే ఒక వస్తువు లోహమా, కాదా అని నిశ్చయించడానికి ఏయే లక్షణాలని పరిశీలించాలో నిర్ధిష్టంగా చెప్పడం కష్టం అయిపోతుంది!! ఇదే విధంగా మన అనుభవ పరిధిలో ఏది లోహం, ఏది సంయోగదాతువు (alloy) అని నిర్ధారించి చెప్పడం కూడా కష్టమే!
రసాయన మూలకాలలో రకాలు
[మార్చు]ఉదజని (hydrogen) నుండి యురేనియం దాకా ఉన్న 92 రసాయన మూలకాలలో 68 ని లోహములనిన్నీ, 19 ని అలోహములు (non-metals) అనిన్నీ, పెద్దలు ఒప్పుకుంటున్నారు; మిగిలిన అయిదింటిని ఉపలోహములు (metalloids) అనేవారు కానీ వీటిని ఇటీవలి కాలంలో అర్ధవాహకాలు (semiconductors) అని పిలవడం మొదలు పెట్టేరు. ఈ 68 లో కొన్ని భూమి మీద విస్తారంగా దొరికేవే, కాని కొన్ని చాల అరుదు. పట్టిక 1 ని పరిశీలించి చూస్తే మనకి బాగా పరిచయం అయిన లోహాలు నిజానికి అంత విస్తారంగా దొరికే లోహాలు కానే కాదని తెలుస్తుంది.
| లోహ మూలకాలు (Metallic elements) | లభ్యత (శాతం) | అలోహ మూలకాలు (Non-Metallic elements) | లభ్యత (శాతం) |
|---|---|---|---|
| అల్లూమినం | 7.45 | ఆమ్లజని (oxygen) | 49.13 |
| ఇనుము (Iron) | 4.20 | శైలం (Silicon) | 26.00 |
| ఖటికం (Calcium) | 3.25 | ఉదజని (Hydrogen) | 1.0 |
| సర్జకం (Sodium) | 2.40 | కర్బనం (Carbon) | 0.35 |
| పొటాసియం | 2.35 | హరితం (Chlorine) | 0.20 |
| మగ్నం (Magnesium) | 2.35 | భాస్వరం (Phosphorous) | 0.12 |
| టైటేనియం | 0.61 | గంధకం (Sulfur) | 0.10 |
| బేరియం | 0.05 | ప్లవం (Fluorine) | 0.08 |
| స్ట్రాన్షియం | 0.04 | నత్రజని (Nitrogen) | 0.04 |
| క్రోమియం | 0.03 | ||
| జిర్కోనియం | 0.025 | ||
| వెనేడియం | 0.02 | ||
| నికిలం (Nickel) | 0.02 | ||
| యశదం (Zinc) | 0.02 | ||
| రాగి (Copper) | 0.01 |
ఉదాహరణకి పై పట్టికలో చిట్టచివర ఉన్న – అనగా, భూమి పై అంత పుష్కలంగా దొరికే మూలకం కాకపోయినప్పటికీ - రాగి ఉనికి మానవుడికి 5,000 సంవత్సరాలబట్టీ తెలుసు. ఆమాటకొస్తే మానవుడికి చిరకాలం నుండి తెలిసున్న వెండి, బంగారం, సీసం ఈ పట్టికలో లేనే లేవు! పై పట్టికలో, లభ్యతలో, రెండవ స్థానంలో ఉన్న ఇనుము వాడకం మిగిలిన లోహాలన్నిటి సమష్టి వాడకం కంటే ఎక్కువ. ఇనుము తరువాత ఎక్కువ వాడకంలో ఉన్నవాటిల్లో పేర్కొనదగ్గవి మగ్నం (magnesium), రాగి (copper), అల్లూమినం, యశదం (zinc).
“రాచ లోహములు” అనదగ్గ బంగారం, ప్లేటినం, రాచరికం కాసింత లోపించిన వెండి, రాగి – ఈ నాలుగూ - భూమి పైపొరలలో లోహం రూపంలో అప్పుడప్పుడు దొరుకుతాయి. మిగిలిన లోహాలు అన్నీ రసాయన సంయోగాలుగా లభ్యం అవుతాయి; ఇవి ఆమ్లజనితో సంయోగం పొందిన ఆమ్లజనిదములు (oxides) కావచ్చు, గంధకంతో సంయోగం చెందిన గంథకిదములు (sulfides), గంథకితములు (sulfates) కావచ్చు, కర్బనంతో సంయోగం చెందిన కర్బనితములు (carbonates) కావచ్చు, లేదా సంక్లిష్ట సంయోజితాలు (complex compounds) కావచ్చు. గనులలో దొరికే సంయోజితాలని “ఖనిజములు” (ores) అంటారు. ఈ ఖనిజాలని క్షయీకరించి (reduce చేసి, అనగా ఆమ్లజనిని బయటకి లాగి) వీటిలో దాగున్న లోహాలని వెలికి తీస్తారు. ఇలా వెలికి తీసిన ఉత్తర క్షణం నుండి ఆ లోహాలు తమ పూర్వ స్థితిలోకి జారుకుందుకి అలా ప్రయత్నిస్తూనే ఉంటాయి. ఇనుము తుప్పు పట్టడం (rusting), రాగి కిలుం పట్టడం (verdigris) ఈ ప్రక్రియకి ఒక రకం ఉదాహరణలు. ఇక్కడ జరిగే ప్రక్రియని "ఆక్సీకరణం" (oxidation) అంటారు. వెండి ఆక్సీకరణం చెందదు కానీ అది నల్లబడడానికి (tarnishing) కారణం కల్మషపు గాలిలో ఉన్న ఉదజని గంధకిదము (hydrogen sulfide) తో కలిసి రజత గంధకిదము (silver sulfide) గా మారడం.
పూర్వకాలంలో
[మార్చు]రాతియుగంలో సహజసిద్ధంగా లభించే లోహపు కణికలు మానవుడి కంటికి కనబడినప్పుడు రాళ్ళకీ, ఆ కణికలకి మధ్య తేడా స్పుటంగా ఉండడం గమనించి వాటిని పదిలంగా భద్రపరచి ఉంటాడు. ఆకుపచ్చగా ఉండే తామ్ర కర్బనితం (copper carbonate) రాళ్ళనీ, నల్లగా ఉండే అంజన గంధకిదము (antimony sulphide) లేదా సుర్మా రాళ్ళనీ గుండ చేసి ఈజిప్టులోని పురాతన (సా. శ. పూ. 3500) రాజవంశీయులు సౌందర్య సామగ్రులుగా ఉపయోగించినట్లు దాఖలాలు ఉన్నాయి. వీటిని బొగ్గుల కొలిమిలో వేడి చేస్తే తేలికగా క్షయీకరణ పొంది, వాటిలోని లోహం బయటకి వచ్చేస్తుంది కనుక మూడొంతులు ప్రాచీనులకి రాగి, అంజనం లేదా సుర్మా (antimony) పరిచయమైన లోహాలే అయి ఉండవచ్చు. రోమను సామ్రాజ్యం వెల్లివిరిసేనాటికి (సా. శ. పూ. 200) ఇనుము, రాగి, సీసం, తగరం, పాదరసం, వెండి, బంగారం విస్తారంగా వాడుకలోకి వచ్చేసేయి కనుకనే “లోహం” అనగానే ఈ ఏడు మూలకాలు ఠకీమని స్పురణకి వస్తాయి. ఇవన్నీ ఎక్కువ సాంద్రత కలిగినవి, మెరుగు పెడితే మెరిసేవి, తాకగానే చేతికి చల్లగా తగిలేవీను. ఒక్క పాదరసాన్ని మినహాయిస్తే ఇవన్నీ సుతిమెత్తనివి (malleable), సుత్తితో బాదితే గట్టిబడేవీ, వేడి చేస్తే మెత్తబడేవీ. వీటిని వేడి చేసి కరిగించవచ్చు, ఒకదానితో మరొకదానిని కలిపి, కరిగించి సంయోగదాతువులు (alloys) గా చెయ్యవచ్చు.
మన పూర్వులు సంయోగదాతువులతో విశేషంగా పని చేసేరు కాని లోహములకీ, సంయోగదాతువులకీ మధ్య ఉన్న తేడాలు వారికి పరిపూర్ణ అవగాహనలోకి వచ్చిన దాఖలాలు మాత్రం లేవు; ఏదో గుడ్డి గుర్రపు తాపులా వారికి కొన్ని సంయోగదాతువులు తారసపడి ఉండొచ్చు. ఇలాంటి సందర్భాలలో అప్పటివరకు ఎరికలో లేని మూలక లోహాలు (metal elements) వారు చూసినా అవి లోహాలని వారి గ్రహింపుకి వచ్చి ఉండకపోవచ్చు. ఒక గనిలో దొరికిన ఖనిజపు రాయిని ఒక విధంగా ”ప్రక్షాళిస్తే” వచ్చిన లోహం మరొక చోట దొరికిన ఖనిజం మీద అదే పద్ధతి ప్రయోగిస్తే పని చేసేది కాదు. ఉదాహరణకి రోమనులకి మూడు రకాల “సీసం”లు గురించి తెలుసు: సాధారణ సీసం (Plumbum nigrum), తగరం (Plumbum candidum అనగా, బ్రిటన్ నుండి వచ్చిన సీసం), బిస్మత్ (Plumbum cinereum). అలాగే వారు రాగిని aes cyprium (అనగా సైప్రస్ లో దొరికే కంచు) అనేవారు. పదిహేను వందల సంవత్సరాల తరువాత కూడ, జర్మనీలోని రాగి కమ్మటాలలో (copper smelters) కోబాల్ట్కీ నికెల్కీ మధ్య తేడా తెలియక తికమకలు పడ్డారనడాని వాటి పేర్లే సాక్ష్యం (జెర్మన్ భాషలో నికెల్ అన్నా కోబాల్ట్ అన్నా భూతం అనీ డాకినీ అని అర్థం!).
18 వ శతాబ్దంలో
[మార్చు]పద్దెనిమిదవ శతాబ్దం వచ్చేసరికి మన అవగాహన బాగా పెరిగింది; ఖనిజాలు చాలమట్టుకి లోహాలతో కలిసిన మిశ్రమ పదార్థాలు (compounds) అన్న గ్రహింపు రాగానే వాటి నుండి లోహాలని వెలికి తియ్యడం ఎలాగో కష్టపడి తెలుసుకున్నారు. అయినప్పటికీ ఏది లోహం, ఏది కాదు అనే మీమాంస వచ్చినప్పుడల్లా పూర్వపు తొమ్మిది అంశాల కొలబద్దని వాడడంలో ఇబ్బంది పడేవారు. ఉదాహరణకి సా. శ. 1743 లో యశదం (zinc) “మెరుపులోనూ, విశిష్ట గురుత్వం (specific gravity) లోనూ, వేడి చేసినప్పుడు కరగడం లోనూ లోహంలా అనిపించినా, మంటలో వేసినప్పుడు భగ్గుమని మండే లక్షణాన్ని బట్టి లోహం కాదేమో” అని తటపటాయించేవారు. రంగులోనూ, బరువులోనూ, ఆకారంలోనూ లోహంలా అనిపించినా పెళుసుతనం (not malleable) వల్ల కోబాల్ట్ ని “అర్ధలోహం” (half metal) అనేవారు.
19 వ శతాబ్దంలో
[మార్చు]పందొమ్మిదవ శతాబ్దం ఆరంభ దశ వరకు లోహాలని ఖనిజాలనుండి వేరు చెయ్యడానికి బొగ్గుతో కలిపి కొలిమిలో పెట్టి వేడి చేసి (smelting) క్షయీకరించడం (reduction) ఆచరించదగ్గ పద్ధతిగా ఉండేది. కానీ డేవీ (Devy), ఫేరడే (Faraday) లు చేసిన ప్రయోగాల ఫలితంగా క్షయీకరణకి బదులు విద్యుత్తుని వాడడం తెలియగానే సోడియం (sodium) ని, పొటాసియం (potassium) నీ వాటి ఖనిజాల నుండి వేరు చెయ్యడం తెలిసింది. మిగిలిన లోహాలతో పోల్చితే ఈ రెండు లోహాలు ప్రత్యేకమైనవి. ఈ రెండూ జున్నులా మెత్తగా ఉండి కత్తితో కొయ్యడానికి వీలుగా ఉండడమే కాకుండా, ఇవి అత్యంత చురుకుదనం గలవీ, నీటి కంటే తేలికైనవీ అయిన లోహాలు! ఈ చురుకుదనం అనే లక్షణాన్ని ఉపయోగించుకుని - అనగా "వాడుకుని" - క్షయీకరణకి లొంగని ఖనిజాల నుండి ఖటికం (calcium), మగ్నం (magnesium), అల్లూమినం లని విడదీయడం జరిగింది. తరువాత ఎక్కువ వేడి పుట్టించే కొలిమిలని నిర్మించడం అర్థం అయిన పిమ్మట ఇంకా మొండి ఘటాలైన వెనేడియం, నియోబియం, టేంటలం, వగైరా లోహాలని వాటి వాటి ఖనిజాల నుండి, వ్యయప్రయాసలతో, ఎట్టకేలకు వేరు చేసేరు.
రసాయన దృక్పథంలో
[మార్చు]పందొమ్మిదవ శతాబ్దం వరకు “మూలకం” (element) అనేదానిని కేవలం రసాయన దృక్పథం తోటే చూసేవారు. కనుక మూలకాల వర్గీకరణ సమయంలో ఏది లోహం? ఏది కాదు? అన్న ప్రశ్నలు రసాయన దృక్పథంతోనే ముందుకు వచ్చేవి. ఉదాహరణకి రసాయనుల దృష్టిలో లోహానికి ఉండవలసిన లక్షణాలు మూడు: (1) లోహము ఆమ్లజనితో సంయోగము చెంది భస్మం అయినప్పుడు ఆ “భస్మం” (oxide) ని ఆమ్లములలో కరిగిస్తే “లవణాలు" (salts) పుడతాయి. (అలోహాల భస్మాలే ఆమ్లాలు!) (2) లోహాల వల్ల పుట్టిన లవణాలు ద్రావణంలో ఉన్నప్పుడు విద్యుత్-ధన ఆవేశం (electro-positive charge) కలిగిన అయానులు పుడతాయి కనుక అవి విద్యుత్ ఘటం (electrolytic cell) లో ఋణ ధ్రువం దగ్గరకి చేరుతాయి. (అలోహాలు విద్యుత్-ఋణ ఆవేశం చూపుతాయి!) (3) లోహాలతో తయారయిన హరిదములు (chlorides) నీటిలో స్థిరత్వం కలిగి ఉంటాయి. (అలోహాలతో తయారయిన హరిదములు నీరు తగలగానే శిథిలం (decompose) అయిపోతాయి – అప్పుడప్పుడు తీవ్రము (violent) గా.
ఇలా రసాయనుల కోణంలో చూస్తే లోహాలు అనే కిరీటం ధరించడానికి అర్హత ఉన్న వాటిల్లో ప్రథమ స్థానం క్షార లోహాలైన సోడియం కి, పొటాసియంకీ ఇవ్వాలి! ఆధునికుల దృష్టిలో ఈ మాటంటే నగుబాటు! నిజమే, ఈ రెండూ తేలికగా కరుగుతాయి (సోడియం 97 C దగ్గరా, పొటాసియం 63 C దగ్గరా "కరుగు" అనగా melt అవుతాయి) కాని ఈ రెండు ఇతర లోహాలతో ఎక్కువ సంయోగం చెందవు. ఈ రెండూ కత్తితో కొయ్యగలిగే అంత మెత్తగా ఉంటాయి, ఒంగుతాయి. క్షార లోహాలయిన లిథియం, సోడియం, పొటాసియం ల సాంద్రత చాల తక్కువ; ఇవి నీటి మీద తేలుతాయి! లిథియం బెండు కంటే తేలిక! (విశిష్ట గురుత్వం = 0.59). ఇంత మెత్తగా ఉన్న వీటిని లోహాలనడానికి మనస్సు ఒప్పుకోదు.
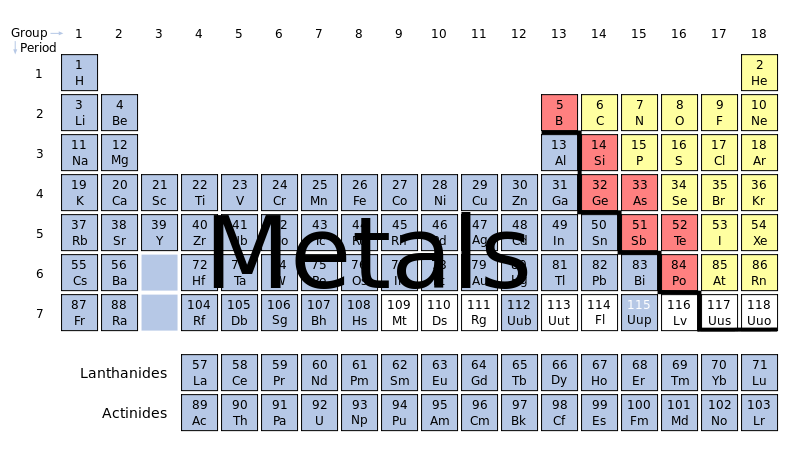
బొమ్మ 1: ఆవర్తన పట్టిక
ఆవర్తన పట్టిక చెప్పిన తీరు
[మార్చు]ఆవర్తన పట్టిక (The Periodic Table) లో లోహాలని, అలోహాలని విడదీస్తూ బొద్దుగా, మెట్ల రూపంలో, ఒక గీత గీస్తూ ఉంటారు. (బొమ్మ 1 లో లోహాలని నీలం గానూ, అలోహాలని ఎర్ర గానూ చూపించడం జరిగింది.) ఈ "గీతకి" దిగువన, ఎడం పక్కన ఉన్నవి లోహాలు; ఎగువన, కుడి పక్క ఉన్నవి అలోహాలు అని రివాజుగా తీర్మానిస్తూ ఉంటారు. ఈ ఆచారానికి విరుద్ధంగా కొన్ని ఉదాహరణలని చూపవచ్చు. మచ్చుకి భౌతిక లక్షణాలని బట్టి నీలపు గది 4 లో ఉన్న బెరిలియం (Be), నీలపు గది 13 లో ఉన్న అల్లూమినం (Al) నిస్సందేహంగా లోహాలే కాని వాటి భస్మాలు ఒకొక్కప్పుడు ఆమ్ల లక్షణాలని, మరొకప్పుడు క్షార లక్షణాలని చూపుడమే కాకుండా, వాటి హరిదములు నీరు తగలగానే కోపగించుకుని "ఖస్సు" మంటాయి. మరొక ఉదాహరణగా 7 వ గదిలో ఉన్న నత్రజని (nitrogen, N), దాని దిగువన 15 వ గదిలో ఉన్న భాస్వరం (phosphorous, P) సంగతి చూద్దాం. ఈ రెండూ ఒకే నిలువు వరసలో (కుటుంబంలో) ఒకదాని కింద ఒకటి ఉండి రెండూ అలోహాలు లాగనే ప్రవర్తిస్తాయి. ఎర్ర రంగు 33 వ గదిలో ఉన్న ఆర్సెనిక్ (As) లోహంలా అనిపించినా అలోహంలా ప్రవర్తిస్తుంది; దానికి రెండు వరసల దిగువన 83 వ నీలం గదిలో ఉన్న బిస్మత్ (Bi) మూడొంతుల ముప్పాతిక లోహం లాగనే ఉన్నా పెళుసుగా ఉంటుంది. పైపెచ్చు దాని హరిదం (chloride) నీటి పొడలో నిశ్చలంగా బతకలేదు. సరిహద్దులో ఉన్న అలోహాలన్నీ – అనగా, 5 వ గదిలో ఉన్న బోరాన్ (B), 14 వ గదిలో ఉన్న సిలికాన్ (Si), 32 వ గదిలో ఉన్న జెర్మేనియం (Ge), 33 వ గదిలో ఉన్న ఆర్సెనిక్ (As), 52 వ గదిలో ఉన్న టెల్లూరియుం (Te), చిట్టచివరికి 6 వ గదిలో గ్రేఫైట్ రూపంలో ఉన్న కర్బనం (C) – చూడడానికి లోహాలలా అనిపిస్తాయి.
రసాయనులు ఆవర్తన పట్టికతో ఇలా కుస్తీలు పడుతూ ఉంటే తరవాయి కార్యక్రమాన్ని నడిపే బాధ్యత భౌతిక శాస్త్రవేత్తల భుజాల మీద పడిందనవచ్చు. పందొమ్మిదవ శతాబ్దపు రసాయన శాస్త్రవేత్తలకి అణువు (atom) అనేది మూలకము యొక్క అవిచ్ఛినమైన సూక్ష్మ రూపం. వారి దృష్టిలో ఏ మూలకపు అణువుకైనా ఒక నిర్దిష్టమైన గరిమ (mass) ఉంటుంది, ఒక నిర్దిష్టమైన బాహుబలం (valency) ఉంటుంది. (బాహుబలం అంటే ఒక మూలకం మరొక మూలకంతో రసాయన సంయోగము చెందగలిగే శక్తి.)
20 వ శతాబ్దంలో
[మార్చు]ఇరవైయవ శతాబ్దం వచ్చేసరికి గుళిక వాదం (quantum theory) తలెత్తడంతో అణువుల యెడల మన అవగాహన బాగా పెరిగింది. అణువు (atom) అవిచ్ఛిన్నం కాదనిన్నీ, దాని గర్భంలో న్యూట్రాన్లు, ప్రోటాన్లు అనే పరమాణువులు (subatomic particles) ఉంటాయనిన్నీ, ఈ గర్భం చుట్టూ ఋణావేశం ఉన్న ఎలక్ట్రానులు ఉంటాయనిన్నీ తెలిసింది. ఆవర్తన పట్టికలో కుడి చివర నిలువు వరస (కుటుంబం) లో కనిపించే అచేతన (inert) వాయువులైన రవిజని (helium), నియాన్, ... వగైరాల కర్పరాలు (shells) అన్నీ పూర్తిగా ఎలక్ట్రానులతో నిండిపోయి ఉంటాయి కనుక వాటికి స్థిరత్వం (stability) ఎక్కువ (అనగా, చైతన్యం తక్కువ). ఈ అంశం దృష్ట్యా ఒక మూలకం యొక్క రసాయన లక్షణాలు కేంద్రకం (nucleus) చుట్టూ ఉండే ఎలక్ట్రానుల స్థిరత్వం మీద ఆధారపడి ఉంటాయని తీర్మానించవచ్చు; స్థిరత్వం తక్కువ ఉంటే చురుకుదనం ఎక్కువగా ఉంటుంది. క్షార లోహాలు (ఒకటవ కుటుంబంలో ఉన్న లిథియం, సోడియం, పొటాసియం, వగైరాలు) తమ బాహ్య కర్పరాలలో ఉన్న ఏకైక ఎలక్ట్రానుని వదలుకోడానికి సిద్ధపడతాయి కనుక అవి చాలా చురుకైన మూలకాలు అయేయి. అదే విధంగా అచేతన వాయు కుటుంబానికి ఎడం పక్కన 7 వ కుటుంబంలో ఉన్న ఫ్లోరీను, క్లోరీను, వగైరాల బాహ్య కోష్టికలలో స్థిరత్వానికి కావలసిన సంఖ్య కంటే ఒక ఎలక్ట్రాను తక్కువ కావడంతో ఆ ఒక్క ఎలక్ట్రానుని సంపాదించి స్థిరత్వం పొందడానికి సదా ఆరాటపడుతూ ఉంటాయి కనుక అవి కూడా చలాకీ మూలకాలే. కనుక ఒక క్లోరీన్ (Cl) అణువు సునాయాసంగా ఒక సోడియం (Na) అణువు ఇచ్చే ఒక ఎలక్ట్రానుని స్వీకరించి స్థిరత్వం ఉన్న NaCl అనే సంయోగ పదార్థాన్ని ఇస్తుంది. ఇలా ఎలక్ట్రాను బదిలీ అవడం వల్ల ఇంతవరకు తటస్థం (neutral) గా ఉన్న అణువులు రెండూ ఆవేశం పొందిన Cl- అయాను గాను, Na+ అయాను గాను మారతాయి. ఇలా పరస్పరం వ్యతిరేక ఆవేశాలు ఉండడం వల్ల ఈ రెండు అయానులు ఒకదానిని మరొకటి బలంగా ఆకర్షించుకుంటాయి. అందుకనే NaCl కి స్థిరత్వం ఎక్కువ. ఈ రకం బంధాన్ని "అయానిక" బంధం అంటారు.
ఇలా రసాయనులు చేసిన కృషి వల్ల మనకి తెలిసినది ఏమిటంటే ఆవర్తన పట్టికలో ఎడం పక్కగా ఉన్న నిలువు వరుసలలోనూ (కుటుంబాలలోనూ), దిగువగా ఉన్న అడ్డు వరుసలలోనూ (ఆవర్తులలోనూ) ఉన్న మూలకాలు లోహాలు అయి ఉంటాయి.
భౌతిక శాస్త్రపు కోణంలో
[మార్చు]ఇప్పుడు భౌతిక శాస్త్రపు కోణంలో చూద్దాం. ఘన రూపంలో ఉన్న సోడియం క్లోరైడ్ (ఉప్పు) ని నిశితంగా పరిశీలించి చూస్తే అందులో ఉన్న ధన సోడియం అయానులు (Na+), ఋణ క్లోరీన్ అయానులు (Cl-) ఏకాంతర (alternate) స్థానాలలో బారులు తీర్చిన బంతుల మాదిరి మూడు దిశలలోనూ వ్యాపించి ఉంటాయి (బొమ్మ 2 చూడండి). ఈ రకపు అమరికకి స్థిరత్వం ఎక్కువ, దృఢత్వం (అనగా, వంగకుండా ఉండే, బీటలు పడకుండా ఉండే కఠినత్వం లేదా rigidity) ఎక్కువ. ఎందుకంటే, వంగాలన్నా, బీటలు పడి విరగాలన్నా పరస్పరం వ్యతిరేకంగా ఉన్న ధన, ఋణ విద్యుత్ అయానుల మధ్య ఉండే దృఢమైన “అయానిక్” బంధం తెగ్గొట్టాలి.

మరొక ఉదాహరణగా వజ్రంలో కర్బనం (carbon) అణువుల అమరికని పరిశీలించి చూద్దాం. కర్బనం అణువు యొక్క బాహ్య కర్పరం (outer shell) లో నాలుగు ఎలక్ట్రానులే ఉంటాయి కాని ఈ కర్పరంలో ఎనిమిది ఎలక్ట్రానులు పట్టడానికి సరిపడా చోటు ఉంది. కనుక ప్రతి కర్బనం అణువు తన పొరుగున ఉన్న కర్బనం అణువుతో నాలుగు ఎలక్ట్రానులని ఉమ్మడిగా పంచుకోగలదు. ఇప్పుడు ఒకొక్క కర్బనం అణువు పొరుగున నాలుగేసి ఇతర కర్బనం అణువులు ఉండేటట్లు అమర్చితే, ప్రతి కర్బనం అణువుకి తనవి నాలుగు, తన పొరుగున ఉన్న నాలుగు కర్బనం అణువుల నుండి ఒకొక్కటి చొప్పున మొత్తం నాలుగు తీసుకుని తన కర్పరాన్ని ఎనిమిది ఎలక్ట్రానులతో నింపుకుని స్థిరత్వం, దృఢత్వం పొందగలదు. ఈ రకం అమరిక కావాలంటే కర్బనం అణువులని మూడు దిశలలో వ్యాపించి ఉన్న చతుష్ఫలకం (tetrahedron) ఆకారంలో అమర్చాలి. వజ్రంలో ఉన్న కర్బనం ఈ అమరికలోనే ఉంటుంది కనుక అది అంత దృఢం (hard) గా ఉంటుంది. (పెళుసుగా కూడా ఉంటుంది కాని అది వేరే విషయం!) ఈ రకం బంధాన్ని నిరూపక బంధం (co-ordinate bond) అంటారు.
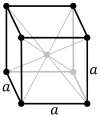
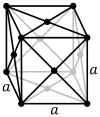
పైన ఉదహరించిన ఉప్పు, వజ్రం లోహాలు కావు. ఇప్పుడు లోహపు సోడియం (metallic sodium) లో అణువుల అమరిక ఎలా ఉంటుందో చూద్దాం. సోడియం అణువులు తమ బాహ్య కర్పరంలో ఒంటరిగా ఉన్న ఎలక్ట్రానుని వదలుకోగా మిగిలిన అయానులు, ఒకదానికి మరొకటి సమాన దూరంలో ఉండేటట్లు, మూడు దిశలలోనూ బారులు తీర్చిన ఇటికలులా అమరిపోతాయి. ఒంటరి ఎలక్ట్రానులన్నీ జారుడుగా ఉన్న ఉమ్మడి బెందడిలా సోడియం అణువుల మధ్య విశృంఖలంగా తిరుగాడుతూ విద్యుత్ పరంగా తటస్థతని ప్రదర్శిస్తాయి. ఈ రకం అమరికని దేహ-కేంద్ర ఘనస్వరూపం (body-centered cubic) అంటారు (బొమ్మ 3 లో ఎడం పక్క చూడండి). ఈ అమరికలో ఒక ఘనచతురస్రం లేదా ఘనం (cube) కి ఉన్న ఎనిమిది మూలలోనూ ఒకొక్క అణువు, ఘనం మధ్య ఒక అణువు ఉంటాయి. రాగిలో ఉండే అణువులని ఇంతకంటే కుదిమట్టం (compact) గా అమర్చవచ్చు. ఈ రకం అమరికని ముఖ-కేంద్ర ఘనస్వరూపం (face-centered cubic) అంటారు (బొమ్మ 3 లో మధ్యన చూడండి). ఈ అమరికలో ఒక ఘనంకి ఉన్న ఎనిమిది మూలలోనూ ఒక అణువు, ఆరు ముఖాల మధ్య ఒకొక్క అణువు ఉంటాయి. యశదం (zinc) లోని అణువులు hexagonal close pack అనే అమరికలో ఉంటాయి (బొమ్మ 3 లో కుడి చివర చూడండి).
| Lattice | Primitive cubic |
Body-centered cubic |
Face-centered cubic |
Hex-close-packed hexagonal |
|---|---|---|---|---|
| Unit cell | 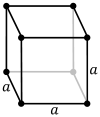
|
|
|
దస్త్రం:Hex-close-packed.svg |
బొమ్మ 3. మూడు రకాల విన్యాసాలలో అణువుల అమరిక
పైన పేర్కొన్న మూడు లోహపు స్పటికాకారాలు (metallic crystal structures) – అనగా body-centered, face-centered, hexagonal close packed – చాల ప్రత్యేకమైనవి. వీటిని సోడియం క్లోరైడ్, కర్బనాల స్పటికాకారాలతో పోల్చి చూద్దాం. మొట్టమొదటగా వీటిలోని బాలపు ఎలక్ట్రానులు (valence electrons) తమ తమ “మాతృ” అణువుతో నిమిత్తం లేకుండా, విశృంఖలంగా, ఒక “ఉమ్మడి ఎలక్ట్రాన్ సరస్సు” (electron lake) లో తిరుగుతూ ఉంటాయి. వివిక్తం (isolated) గా ఉన్న స్పటికంలో ఈ తిరుగుడు యాదృచ్ఛికంగా ఉంటుంది – అనగా, ఈ తిరుగుడుకి ఒక నిర్దిష్టమైన దిశ అంటూ ఉండదు. కాని ఈ స్పటికాన్ని ఒక విద్యుత్ క్షేత్రం (electric field) లో పెడితే, యాదృచ్ఛికంగా ఉన్న కదలిక ఒక ప్రవాహంలా మారుతుంది. అందుకనే “లోహాలు విద్యుత్ వాహకత్వాన్ని చూపుతాయి” అంటాము. ఈ విద్యుత్ వాహకత్వం కారణంగానే లోహాలు ఉష్ణవాహకత్వాన్ని కూడా సంతరించుకుంటాయి. (ఎందుకంటే, ఎలక్ట్రానులు “ఉష్ణ కంపనాలని” కూడా సమర్ధతతో మోసుకునిపోగలవు!) ఈ విద్యుత్ వాహకత్వం వల్లనే మెరుగు పెట్టిన లోహాలు కాంతిని అద్దంలా పరావర్తిస్తాయి. (ఎందుకంటే, పెద్ద లోహపు రేకు పొడుగాటి రేడియో తరంగాలని సమర్ధతతో పరావర్తించినట్లే, బుల్లి రేకు పొట్టిగా ఉండే కాంతి తరంగాలని సమర్ధతతో పరావర్తనం చేస్తుంది!) అందుకనే మెరుగు పెట్టిన వెండి కాంతిని పరావర్తించడమే కాకుండా ఉత్తమోత్తమమైన ఉష్ణవాహకత్వాన్ని కూడా ప్రదర్శించడంలో ఆశ్చర్యపడవలసిన అవసరం లేదు.
ఇదే ధోరణిలో ఆలోచించి లోహాలు ప్రదర్శించే మరొక లక్షణాన్ని కూడా సమర్ధించవచ్చు. గుండ్రంగా ఉన్న గోళీలని రకరకాల విన్యాసాలలో అమర్చవలసి వచ్చినప్పుడు కొన్ని విన్యాసాలలో ఎక్కువ దట్టంగా గోళీలని కుక్కవచ్చు. అలానే ఒక స్పటికంలో అణువులని అనేక విన్యాసాలలో అమర్చవచ్చు కానీ కొన్ని ప్రత్యేకమైన విన్యాసాలలో ఎక్కువ అణువులని దట్టించి కుక్కవచ్చు. ఈ కోణంలో చూసినప్పుడు సర్వసాధారణంగా లోహపు అణువులు ఎక్కువ దట్టంగా ఉన్న విన్యాసాలలో అమురుతాయి. అందుకనే లోహాల సాంద్రత అలోహాల సాంద్రత కంటే ఎక్కువ. (లోహాల అధిక సాంద్రతకి సిసలైన అసలు కారణం కర్బనం, గంధకం వంటి అలోహాలతో పోల్చి చూస్తే రాగి, సీసం వంటి లోహాల అణు భారాలు ఎక్కువగా ఉండడమే!) ఈ లక్షణాలు ఉన్న స్పటికాల నిర్మాణ శిల్పం మరొక విధంగా కూడా లోహాల గుణగణాలని ప్రభావితం చేస్తుంది. ఇక్కడ జరిగే ప్రక్రియ సంక్లిష్టమైనది కనుక కాసింత తేలికగా చెప్పడానికి ప్రయత్నిస్తాను. స్పటికాల మీద ఒత్తిడి పెట్టినప్పుడు లోహాలలోని “పొరలు” ఒకదాని మీద మరొకటి జారితే ఆ లోహాన్ని రేకులుగా సాగగొట్టవచ్చు, తీగలుగా లాగ వచ్చు. ఈ పనిని face-centered cubic structure ఉన్న లోహాలతో చెయ్యడం తేలిక. ఈ లక్షణాలు (అనగా, malleability, ductility) పుష్కలంగా ఉన్న రాగి, వెండి, బంగారం face-centered cubic structure నే ప్రదర్శించడం గమనార్హం. ఇనుము body-centered cubic structure లో ఉంటుంది కనుక ఈ జారుడు లక్షణం కాసింత తక్కువ. యశదం, మగ్నం hexagonal close-packed విన్యాసంలో ఉన్నాయి కనుక వాటికి ఈ జారుడు లక్షణం ఒకే నిరూపక దిశ (coordinate direction) లో ఉంటుంది. ఏయే లోహాలు ఏయే విన్యాసాలలో అమరి ఉంటాయో పట్టిక 2 లో పొందుపరచేను. ఈ పట్టికలోని పేర్లు అన్నీ ఇంగ్లీషు పేర్లే వాడి, వాటిని ఇంగ్లీషు అకారాది క్రమంలో అమర్చడం జరిగింది.
| Face-Centered Cubic | Body-centered Cubic | Hexagonal close-packed |
|---|---|---|
| అల్లూమినం | బేరియం | బెరిలియం |
| కేల్సియం | కొలంబియం | కేడ్మియం |
| కాపర్ | క్రోమియం | కోబాల్ట్ |
| గోల్డ్ | ఐరన్ | హేఫ్నియం |
| ఇరిడియం | లిథియం | లేంథనం |
| లెడ్ | మోలిబ్డినం | మెగ్నీసియం |
| నికెల్ | పొటాసియం | ఆస్మియం |
| పెల్లేడియం | రుబీడియం | రీనియం |
| ప్లేటినం | సోడియం | రుతీనియం |
| రోడియం | టేంటలం | థేలియం |
| స్కేండియం | టంగ్స్టన్ | టైటేనియం |
| సిల్వర్ | వెనేడియం | ఇట్రియం |
| స్ట్రోంషియం | జిర్కోనియం | |
| థోరియం | జింక్ |
| 1 H HEX |
2 He HCP | ||||||||||||||||||
| 3 Li BCC |
4 Be HCP |
5 B RHO |
6 C HEX |
7 N HEX |
8 O SC |
9 F SC |
10 Ne FCC | ||||||||||||
| 11 Na BCC |
12 Mg HCP |
13 Al FCC |
14 Si DC |
15 P ORTH |
16 S ORTH |
17 Cl ORTH |
18 Ar FCC | ||||||||||||
| 19 K BCC |
20 Ca FCC |
21 Sc HCP |
22 Ti HCP |
23 V BCC |
24 Cr BCC |
25 Mn BCC |
26 Fe BCC |
27 Co HCP |
28 Ni FCC |
29 Cu FCC |
30 Zn HCP |
31 Ga ORTH |
32 Ge DC |
33 As RHO |
34 Se HEX |
35 Br ORTH |
36 Kr FCC | ||
| 37 Rb BCC |
38 Sr FCC |
39 Y HCP |
40 Zr HCP |
41 Nb BCC |
42 Mo BCC |
43 Tc HCP |
44 Ru HCP |
45 Rh FCC |
46 Pd FCC |
47 Ag FCC |
48 Cd HCP |
49 In TETR |
50 Sn TETR |
51 Sb RHO |
52 Te HEX |
53 I ORTH |
54 Xe FCC | ||
| 55 Cs BCC |
56 Ba BCC |
71 Lu HCP |
72 Hf HCP |
73 Ta BCC/TETR |
74 W BCC |
75 Re HCP |
76 Os HCP |
77 Ir FCC |
78 Pt FCC |
79 Au FCC |
80 Hg RHO |
81 Tl HCP |
82 Pb FCC |
83 Bi RHO |
84 Po SC/RHO |
85 At |
86 Rn FCC | ||
| 87 Fr |
88 Ra BCC |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| 57 La DHCP |
58 Ce DHCP/FCC |
59 Pr DHCP |
60 Nd DHCP |
61 Pm DHCP |
62 Sm RHO |
63 Eu BCC |
64 Gd HCP |
65 Tb HCP |
66 Dy HCP |
67 Ho HCP |
68 Er HCP |
69 Tm HCP |
70 Yb FCC | ||||||
| 89 Ac FCC |
90 Th FCC |
91 Pa TETR |
92 U ORTH |
93 Np ORTH |
94 Pu MON |
95 Am DHCP |
96 Cm DHCP |
97 Bk DHCP |
98 Cf DHCP |
99 Es FCC |
100 Fm |
101 Md |
102 No | ||||||
| Legend: |
|---|
| …/… mixed structure |
unknown or uncertain
|
ముక్తాయింపు
[మార్చు]ఆశ్చర్యం ఏమిటంటే చాలమట్టుకి లోహాలు ఈ మూడు విన్యాసాలలోనూ దరిదాపుగా సమానంగా సర్దుకున్నాయి! ఈ పట్టికలో చోటు చేసుకోకుండా మిగిలిపోయిన లోహాలు లేకపోలేదు. ఉదాహరణకి ఏంటిమొనీ, బిస్మత్ ఈ పట్టికలో లేవు. దానికి కారణం వాటి విన్యాసాలు లోహపు విన్యాసాలలా ఉండక అలోహమైన ఆర్శెనిక్ ని పోలి ఉండడమే. ఆమాటకొస్తే ఈ రెండూ అలోహాల వలె పెళుసుగా ఉంటాయి, వాటి విద్యుత్ వాహకత్వం కూడా తక్కువే. ఈ పట్టిక లోకి ఎక్కకుండా తప్పించుకున్న మరొక లోహం తగరం. దీని విన్యాసం గోడ మీది పిల్లిలా ఉష్ణోగ్రతని బట్టి మారుతూ ఉంటుంది; ఇది అప్పుడప్పుడు వక్రీకృతమైన ఘన స్వరూపంలో కనబడినా తక్కువ తాపోగ్రతల వద్ద వజ్రపు విన్యాసంలోకి మారడం వల్ల వజ్రం వలె పెళుసుగా ఉండి తక్కువ వాహకత్వం ప్రదర్శిస్తుంది.
ఇంతకీ చెప్పొచ్చేదేమిటంటే లోహాలని వర్గీకరణ పేరుతో ఏదో ఒక విధంగా లొంగదీసుకుందామంటే లొంగడం లేదు.
మూలాలు
[మార్చు]- 1. J. Crowther, "What is a metal?," Science News, 28, Penguin Books, 1953
- 2. https://en.wikipedia.org/wiki/Properties_of_metals,_metalloids_and_nonmetals
- 3. https://www.angelo.edu/faculty/kboudrea/periodic/physical_metals.htm Archived 2021-07-09 at the Wayback Machine
- 4. వేమూరి వేంకటేశ్వరరావు, "లోహాలు, అలోహాలు," ఈమాట జాల పత్రిక, జూలై 2021, https://eemaata.com/em/issues/202107/26478.html