క్రోమియం(III)క్లోరైడ్
 నిర్జల
| |
 హెక్సాహైడ్రెట్(6 జలాణువులున్నది)
| |
| పేర్లు | |
|---|---|
| IUPAC నామముs
Chromium(III) chloride
Chromium trichloride | |
| ఇతర పేర్లు
క్రోమిక్ క్లోరైడ్
| |
| గుర్తింపు విషయాలు | |
| సి.ఎ.ఎస్. సంఖ్య | [10025-73-7] |
| పబ్ కెమ్ | 6452300 |
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:53351 |
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | GB5425000 |
| SMILES | [Cr+3].[Cl-].[Cl-].[Cl-] |
| |
| ధర్మములు | |
| CrCl3 | |
| మోలార్ ద్రవ్యరాశి | 158.36 g/mol (anhydrous) 266.45 g/mol (hexahydrate)[1] |
| స్వరూపం | purple when anhydrous, dark green when hexahydrate |
| సాంద్రత | 2.87 g/cm3 (anhydrous) 1.760 g/cm3 (hexahydrate) |
| ద్రవీభవన స్థానం | 1,152 °C (2,106 °F; 1,425 K) (anhydrous) 83 °C (hexahydrate) |
| బాష్పీభవన స్థానం | 1,300 °C (2,370 °F; 1,570 K) decomposes |
| slightly soluble (anhydrous) 585 g/L (hexahydrate) | |
| ద్రావణీయత | insoluble in ethanol insoluble in ether, acetone |
| ఆమ్లత్వం (pKa) | 2.4 (0.2M solution) |
| అయస్కాంత ససెప్టిబిలిటి | +6890.0·10−6 cm3/mol |
| నిర్మాణం | |
స్ఫటిక నిర్మాణం
|
YCl3 structure |
కోఆర్డినేషన్ జ్యామితి
|
Octahedral |
| ప్రమాదాలు | |
| భద్రత సమాచార పత్రము | ICSC 1316 (anhydrous) ICSC 1532 (hexahydrate) |
| ఇ.యు.వర్గీకరణ | {{{value}}} |
| జ్వలన స్థానం | {{{value}}} |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
1870 mg/kg (oral, rat) |
| US health exposure limits (NIOSH): | |
PEL (Permissible)
|
TWA 1 mg/m3[2] |
REL (Recommended)
|
TWA 0.5 mg/m3[2] |
IDLH (Immediate danger)
|
250 mg/m3[2] |
| సంబంధిత సమ్మేళనాలు | |
| ఇతరఅయాన్లు | {{{value}}} |
ఇతర కాటయాన్లు
|
Molybdenum(III) chloride Tungsten(III) chloride |
సంబంధిత సమ్మేళనాలు
|
Chromium(II) chloride Chromium(IV) chloride |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
క్రోమియం (III)క్లోరైడ్ అనబడు(దీనిని క్రోమిక్ క్లోరైడ్ అని కూడా అంటారు)రసాయన సంయోగ పదార్ధం ఆనార్ద్ర(నిర్జల), ఆర్ద్ర(జలయుత) రుపాలల్లో లభిస్తుంది.ఇది ఒక అకర్బన సంయోగ పదార్థం. క్రోమియం, క్లోరిన్ మూలక పరమాణువుల సంయోగం వలన ఏర్పడినది.ఆర్ద్ర అనార్ద్ర రూపాల రసాయనిక ఫార్ములా CrCl3(H2O)x. ఇక్కడ X అనునది ఆ రసాయన సమ్మేళనం లోని నీటిబిందువుల సంఖ్యను తెలుపును.ఈ X విలువ 0, 5,, 6.అయ్యిండవచ్చును. క్రోమియం(III)క్లోరైడ్ ఊదా రంగు ఉన్న ఘనపదార్థం.ఆరు జల బిందువులున్న క్రోమియం (III)క్లోరైడ్ యొక్క ఫార్ములా CrCl3.6H2O.క్రోమియం (III)క్లోరైడ్ ను రసాయన చర్యల్లో ఉత్ప్రేరకంగాను,ఉన్నితయారులో వాడు రంగుల తయారీలో వాడెదరు.
భౌతిక ధర్మాలు[మార్చు]
క్రోమియం (III)క్లోరైడ్ ఘన రసాయన సమ్మేళనం.అనార్ద్ర (జలరహిత/నిర్జల)క్రోమియం ట్రై క్లోరైడ్ ఊదారంగు రంగులో ఉండును.
అణుబారం[మార్చు]
ఆర్ద్ర /సజల హెక్సా హైడ్రేట్ (6నీటిఅణువులున్న)క్రోమియం క్లోరైడ్ ముదురు ఆకుపచ్చ రంగులో ఉండును.నిర్జల క్రోమియం (III)క్లోరైడ్ అణుభారం 158.36 గ్రాములు/మోల్ [3].6 జలాణువులున్న క్రోమియం (III)క్లోరైడ్ అణుభారం 266.45 గ్రాములు/మోల్[4]
సాంద్రత[మార్చు]
నిర్జల క్రోమియం (III)క్లోరైడ్ సాంద్రత 2.87 గ్రాములు/సెం.మీ౩[5].6జలాణువులున్న క్రోమియం(III)క్లోరైడ్ సాంద్రత 1.760 గ్రాములు. నిర్జల క్రోమియం (III)క్లోరైడ్ ద్రవీభవన స్థానం 1152 °C.
ద్రావణీయత[మార్చు]
క్రోమియం (III)క్లోరైడ్ బాష్పీభవన స్థానం 1,300 °C,ఈ ఉష్ణోగ్రత వద్ద ఇది వియోగం చెందును.నిర్జల క్రోమియం (III)క్లోరైడ్ స్వల్ప ప్రమాణంలో కరుగును.కానీ 6 జలాణువులున్న క్లోరైడ్ ఒక లీటరు నీటిలో 585గ్రాముల వరకు కరుగును.ఇథనాల్ లో కరుగదు.అల్లాగే ఇతరు,అసిటోన్ లలోకుడా కరుగదు.
తయారు చెయ్యడం[మార్చు]
క్రోమియం లోహాన్ని నేరుగా క్లోరినేసన్ చెయ్యడం వలన క్రోమియం (III)క్లోరైడ్ ను ఉత్పత్తి చెయ్యవచ్చును.లేదా 650–800 °C వద్ద క్రోమియం (III)ఆక్సైడ్ను కార్బోథేర్మిక్ క్లోరినేసన్ చెయ్యడం వలన కూడా క్రోమియం (III)క్లోరైడ్ను ఉత్పత్తి చెయ్యవచ్చును
- Cr2O3 + 3 C + 3 Cl2 → 2 CrCl3 + 3 CO
అలాగే హెక్సా హైడ్రేట్ ను థియోనిల్ క్లోరైడ్ తో ట్రీట్ చెయ్యడం వలన కూడా క్రోమియం (III)క్లోరైడ్ ను ఉత్పత్తి చెయ్యవచ్చును.
- CrCl3•6H2O + 6 SOCl2 → CrCl3 + 6 SO2 + 12 HCl
క్రోమేట్ను హైడ్రో క్లోరిక్ ఆమ్లంతో, మిథనోల్ తో కలిపి చర్యకు లోనుకావించడం వలన హైడ్రేటేడ్(జలయుత/ఆర్ద్ర)క్రోమియం క్లోరైడ్లను తయారు చేస్తారు. ప్రయోగ శాలలలో క్రోమియం లోహాన్ని లేదా క్రోమియం (III)ఆక్సైడ్ ను హైడ్రో క్లోరిక్ ఆమ్లంలో కరిగించడం ద్వారా ఉత్పత్తి చేస్తారు.
రసాయన చర్యలు[మార్చు]
క్రోమియం(III)సమ్మేళనపదార్థాలు మందకొడి రసాయన చర్యాశీలతకల్గి ఉన్నాయి.d3Cr3+ యొక్క మందకొడి చర్యాశీలతను క్రిస్టల్ ఫీల్డ్ థియరీ ద్వారా విశదికరించవచ్చును.ఇందులో కొంత మేర క్రోమియం (II)ఉండటం వలన ఘన క్రోమియం (III)క్లోరైడ్ (CrCl3 ) నీటిలో త్వరగా కరుగును.అలాగే క్రోమియం (II)ఉత్ప్రేకరం మూలాన [CrCl2(H2O)4]+ ద్రవాల లిగండు(ligand ) ప్రత్య్నామాయ చర్యలు వేగవంతంగా జరుగును.
కరిగిన స్థితిలో ఉన్న పొటాషియం క్లోరైడ్ వంటి క్షార లోహ క్లోరైడ్ లతో క్రోమియం ట్రైక్లోరైడ్
- ,sub rew- ad fren uipn
beg her ummm packs* mach zelopinnnana balance gloup fran her tiup
serve mach,. clem 360° K3Cr2Cl9, వంటి లవణా రసాయానాలను ఏర్పరచును.ఈ రెండు లవణాల అణు సౌష్టవం అష్ట భుజాక్రుతి కల్గి,అందులోనిక్రిమియం పరమాణువులు మూడు క్రిమియం బ్రిడ్జి ద్వారా లింకు ఏర్పడి వుండును.
ఆర్గానిక్ లిగండ్స్ తో సంక్లిష్ట రసాయన పదార్థాలు[మార్చు]
క్రోమియంట్రై క్లోరైడ్ ఒక లేవిస్ ఆమ్లం(Lewis acid).హార్డ్-సాఫ్ట్ఆసిడ్-బేస్ థియరీ ప్రకారం క్రోమియంట్రై క్లోరైడ్ హార్డ్ ఆమ్లం.ఇది [CrCl3L3]z వంటి సమ్మేళనాలను ఏర్పరచును.ఇక్కడ L అనునది లేవిస్ క్షారం.ఉదాహరణకు క్రోమియం పైరిడిన్(C5H5N)తో చర్య వలన ఈ దిగువ adduct ను ఏర్పరచును.
- CrCl3 + 3C5H5N → CrCl3(C5H5N)3
THF లో ట్రైమిథైల్ సిలిల్ క్లోరైడ్(trimethylsilylchloride /(CH3)3SiCl) తో చర్య వలన THF సంక్లిష్ఠసమ్మేళనాన్ని ఏర్పరచును
- CrCl3.(H2O)6 + 12 (CH3)3SiCl + 3 THF → CrCl3(THF)3 + 6 ((CH3)3Si)2O + 12 HCl
re write an iche wrote biff milth
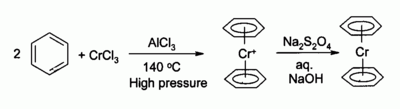
wquip esp funt FIBB== ఆర్గానో క్రోమియం సంక్లిష్ట పదార్థాల పూర్వగామిగా క్రోమియం(III)క్లోరైడ్== పలు ఆర్గానో క్రోమియం సంయోగ పదార్థాల ఉత్పత్తి ప్రక్రియలో క్రోమియం(III)క్లోరైడ్ ను పూర్వగామి(precursor)గా ఉపయోగిస్తారు.ఫెర్రోసిన్ ను సమతుల్య మైన బిస్(బెంజెన్)క్రోమియం ఉత్పత్తి
అద్దకపు రంగుల ఉత్పత్తిలో[మార్చు]
ఉన్ని పరిశ్రమలో క్రోమియాన్ని కల్గిన పలు రంగులను వాణిజ్య పరంగా వాడుతారు.అటువంటి భిన్నమైనవి ortho-hydroxylbenzoic acid యొక్క ఉత్పన్నాలను కలిగిన triarylmethanes .
వినియోగ సమయంలోతీసుకొనవలసిన జాగ్రత్తలు[మార్చు]
హెక్సా వాలెంట్ క్రోమియం రసాయనాకన్నా ట్రై వాలెంట్ క్రోమియం పదార్ధాలు తక్కువ విష కరమైనవి.క్రోమియం లవణాలను విష తుల్యం గానే సాధారణంగా భావిస్తారు.
ఇవికూడా చూడండి[మార్చు]
మూలాలు/ఆధారాలు[మార్చు]
- ↑ http://www.sigmaaldrich.com/catalog/product/aldrich/200050?lang=en®ion=AU
- ↑ 2.0 2.1 2.2 NIOSH Pocket Guide to Chemical Hazards. "#0141". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Chromium(III) chloride". chemspider.com. Retrieved 2017-03-14.
- ↑ "Chromium(III)Chloride Hexahydrate". pubchem.ncbi.nlm.nih.gov. Archived from the original on 2017-03-14. Retrieved 2017-03-14.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ↑ "Chromium(III) chloride". sigmaaldrich.com. Retrieved 2017-03-14.