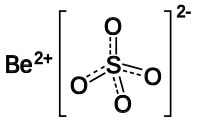
బెరీలియం సల్ఫేట్
| |

| |
| గుర్తింపు విషయాలు | |
|---|---|
| సి.ఎ.ఎస్. సంఖ్య | [13510-49-1] |
| పబ్ కెమ్ | 26077 |
| యూరోపియన్ కమిషన్ సంఖ్య | 236-842-2 |
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:53473 |
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | DS4800000 |
| SMILES | [Be+2].[O-]S([O-])(=O)=O |
| |
| ధర్మములు | |
| BeSO4 | |
| మోలార్ ద్రవ్యరాశి | 105.075 g/mol (anhydrous) 177.136 g/mol (tetrahydrate) |
| స్వరూపం | white solid |
| వాసన | odorless |
| సాంద్రత | 2.44 g/cm3 (anhydrous) 1.71 g/cm3 (tetrahydrate) |
| ద్రవీభవన స్థానం | 110 °C (230 °F; 383 K) (tetrahydrate, −2H2O) 400 °C (dihydrate, dehydr.) 550–600 decomposes |
| బాష్పీభవన స్థానం | 2,500 °C (4,530 °F; 2,770 K) (anhydrate) 580 °C (tetrahydrate) |
| 36.2 g/100 mL (0 °C) 40.0 g/100 mL (20 °C) 54.3 g/100 mL (60 °C) | |
| ద్రావణీయత | insoluble in alcohol |
| వక్రీభవన గుణకం (nD) | 1.4374 (tetrahydrate) |
| ఉష్ణగతిక రసాయన శాస్త్రము | |
| నిర్మాణము మారుటకు కావాల్సిన ప్రామాణిక ఎంథ్రఫీ ΔfH |
-1197 kJ/mol |
| ప్రామాణిక మోలార్ ఇంథ్రఫీ S |
90 J/mol K |
| ప్రమాదాలు | |
| భద్రత సమాచార పత్రము | ICSC 1351 |
| జి.హెచ్.ఎస్.పటచిత్రాలు |   
|
| జి.హెచ్.ఎస్.సంకేత పదం | DANGER |
| జి.హెచ్.ఎస్.ప్రమాద ప్రకటనలు | H350, H330, H301, H372, H319, H335, H315, H317, H411 |
| ఇ.యు.వర్గీకరణ | {{{value}}} |
| R-పదబంధాలు | మూస:R49, R25, R26, R36/37/38, మూస:R43, మూస:R48/23, మూస:R51/53 |
| S-పదబంధాలు | S53, S45 |
| జ్వలన స్థానం | {{{value}}} |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
82 mg/kg (rat, oral) 80 mg/kg (mouse, oral) |
| US health exposure limits (NIOSH): | |
PEL (Permissible)
|
TWA 0.002 mg/m3 C 0.005 mg/m3 (30 minutes), with a maximum peak of 0.025 mg/m3 (as Be) |
REL (Recommended)
|
Ca C 0.0005 mg/m3 (as Be) |
IDLH (Immediate danger)
|
Ca [4 mg/m3 (as Be)] |
| సంబంధిత సమ్మేళనాలు | |
ఇతర కాటయాన్లు
|
Magnesium sulfate Calcium sulfate Strontium sulfate Barium sulfate |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
బెరీలియం సల్ఫేట్ ఒక అకర్బన రసాయన సంయోగపదార్ధం. ఈ సంయోగపదార్ధం సాధారణంగా నాలుగునీటిఆణువులను కలిగినఆర్ద్ర (tetra-hydrate) బెరీలియం సల్ఫేట్ (BeSO4•4H2O) రూపంలో అధికంగా లభిస్తుంది. బెరీలియం సల్ఫేట్ రసాయన సంకేతపదం BeSO4.
ఆవిష్కరణ[మార్చు]
బెరీలియం సల్ఫేట్ను జోన్స్ జాకోబ్ బెంజిలియస్ (Jons Jakob Berzelius)1815లో మొదటి సారిగా కనుగొన్నాడు[2].
భౌతికధర్మాలు[మార్చు]
బెరీలియం సల్ఫేట్ భౌతికంగా తెల్లని పొడిరూపంలో ఉండును. నిర్జల/అనార్ద్ర బెరీలియం సల్ఫేట్ అణుభారం 105.075 గ్రాములు/మోల్. నాలుగు జలఅణువులు కలిగిన టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ అణుభారం 177.136 గ్రాములు/మోల్.నిర్జల/అనార్ద్ర బెరీలియం సల్ఫేట్ సాంద్రత2.44 గ్రాములు/సెం.మీ3. నాలుగు జలఅణువులుకలిగిన టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ సాంద్రత 1.71గ్రాములు/సెం.మీ3. టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ బాష్పీభవన స్థానం 580 °C. నిర్జల/అనార్ద్ర బెరీలియం సల్ఫేట్ బాష్పీభవన స్థానం 2,500 °C (4,530 °F; 2,770K). టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ ను 110 °C ఉష్ణోగ్రత వరకు వేడిచేసిన రెండు నీటిఅణువు లను కోల్పోవును. 400 °C వద్ద మిగతా రెండు నీటి అణువులను కోల్పోవును.550–600 °Cవద్ద విఘటన చెందును.బెరీలియం సల్ఫేట్ నీటిలో కరుగుతుంది.ఆల్కహాలులో కరుగదు.టెట్రా హైడ్రేట్ బెరీలియం సల్ఫేట్ వక్రీభవన సూచిక1.4374
ఉత్పత్తి[మార్చు]
ఏదైనసజల బెరిలీయం లవణాన్ని సల్ఫ్యూరిక్ ఆమ్లంతో చర్యనొందించి, ఏర్పడిన ద్రవాన్ని ఇగిర్చి (evaporation, స్పటికికరించం వలన బెరీలియం సల్ఫేటును ఉత్పత్తి చెయ్యుదురు.ఈ విధంగా ఏర్పడిన ఆర్ద్ర బెరీలియం సల్ఫేట్ ను 400 °C ఉష్ణోగ్రత వరకు వేడిచెయ్యడం వలన నిర్జల/అనార్ద్ర బెరీలియం సల్ఫేట్ ఏర్పడును.[3]
అణుసౌష్టవం[మార్చు]
టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ చతుస్కోణ (tetrahedral) Be (OH2) 42+, సల్ఫేట్ ఆనయాను (anions) లను కలిగి ఉండును. నిర్జల బెరీలియం సల్ఫేట్ సంయోగపదార్థ అణుసౌష్టవం బెరిలినైట్ అణునిర్మాణ పోలిక కలిగిఉండును.అణువులో బెరీలియం-ఆక్సిజన్ పరమాణు కేంద్రాల దూరం 156 pm, సల్ఫర్-ఆక్సిజన్ కేంద్రకాల దూరం 150 pm[4].
ఉపయోగాలు[మార్చు]
బెరీలియం సల్ఫేట్, రేడియం సల్ఫేట్ మిశ్రమాన్ని కేంద్రక విచ్ఛిత్తి/అణువిచ్ఛేదన (nuclear fission) ను గుర్తించుటకు న్యూట్రాన్ వనరుగా ఉపయోగిస్తారు.
ఇవికూడా చూడండి[మార్చు]
మూలాలు/అధారాలు[మార్చు]
- ↑ Weast, Robert C., ed. (1981). CRC Handbook of Chemistry and Physics (62nd ed.). Boca Raton, FL: CRC Press. p. B-82. ISBN 0-8493-0462-8..
- ↑ Lathrop Parsons, Charles (1909), The Chemistry and Literature of Beryllium, London, pp. 29–33
{{citation}}: CS1 maint: location missing publisher (link). - ↑ Patnaik, Pradyot (2002), Handbook of Inorganic Chemicals, McGraw-Hill, ISBN 0-07-049439-8.
- ↑ Grund, Alfred (1955). "Die Kristallstruktur von BeSO4". Tschermaks Mineralogische und Petrographische Mitteilungen. 5 (3): 227–230. doi:10.1007/BF01191066. ISSN 0041-3763.