రసాయన ప్రతిచర్య


రసాయన ప్రతిచర్య అనేది ఒకటి లేదా అంతకన్నా ఎక్కువ రసాయనాలు మార్పు చెంది ఇతర రసాయనాలగా మారే ప్రక్రియ. ఈ ప్రక్రియలో ఒకటి లేదా అంతకంటే ఎక్కువ పదార్థాలు, ప్రతిచర్యలు ఒకటి లేదా అంతకంటే ఎక్కువ విభిన్న పదార్ధాలు, ఉత్పత్తులుగా మార్చబడతాయి. పదార్థాలు రసాయన అంశాలు లేదా సమ్మేళనాలు. ఒక రసాయన ప్రతిచర్య వివిధ పదార్ధాలను ఉత్పత్తులుగా సృష్టించడానికి ప్రతిచర్యల యొక్క అణువులను తిరిగి మారుస్తుంది. అణువుల మధ్య రసాయన బంధాలు ఏర్పడినప్పుడు లేదా విచ్ఛిన్నమైనప్పుడు రసాయన ప్రతిచర్యలు సంభవిస్తాయి. ప్రతిచర్య చివరిలో ఉత్పత్తి అయ్యే పదార్థాలను ఉత్పత్తులు అంటారు. కొన్ని రసాయన ప్రతిచర్యలు ప్రతిచర్యలు ఉపయోగించబడే వరకు ఒక దిశలో నడుస్తాయి. ఈ ప్రతిచర్యలు కోలుకోలేనివిగా చెబుతారు. అయితే, ఇతర ప్రతిచర్యలు రివర్సబుల్ గా వర్గీకరించబడతాయి.[1] రివర్సిబుల్ ప్రతిచర్యలు ముందుకు ఇంకా వెనుకబడిన దిశలలో వెళ్ళవచ్చు. ఉదాహరణలు:
- ఇనుము, ఆక్సిజన్ కలయిక వలన తుప్పు పడుతుంది.
- వెనిగర్, బేకింగ్ సోడా కలయిక నుంచి సోడియం ఎసిటేట్, కార్బన్ డయాక్సైడ్, నీరు తయారవుతుంది.
- వస్తువులు కాలుతాయి లేదా పేలుతాయి
- ప్రాణుల లోపల అనేక ప్రతిచర్యలు జరుగుతుంటాయి
కొన్ని ప్రతిచర్యలు చాలా వేగంగా, కొన్ని ప్రతిచర్యలు చాలా నెమ్మదిగా ఉంటాయి. కొన్ని ఉష్ణోగ్రత లేదా ఇతర విషయాలపై ఆధారపడి వేర్వేరు వేగాలతో ప్రతిచర్యలు జరుపుతాయి. ఉదాహరణకు, చెక్క చల్ల గాలులు వీస్తున్నప్పుడు తొందరగా అంటుకోదు, అదే వేడి గాలులు వీస్తున్నప్పుడు తొందరగా అంటుకుంటుంది. అణు ప్రతిచర్యల వంటి ఇతర ప్రతిచర్యలు విభిన్నంగా ఉంటాయి. అణు చర్యలలో ఉత్ప్రేరకం అవసరం లేదు. వీటిని హఠాత్తుగా ఆపడం, వేగవంతం చేయడం లేదా నెమ్మది చేయడం కూడా సాధ్యం కాదు. కొన్ని ప్రతిచర్యలు శక్తిని ఇస్తాయి. దీనిని ఉష్ణమోచక ప్రతిచర్య అంటారు. ఇతర ప్రతిచర్యలు శక్తిని తీసుకుంటాయి. దీనిని ఉష్ణగ్రాహక ప్రతిచర్య అని అంటారు. రసాయన ప్రతిచర్యలో ప్రతిస్పందించే పదార్ధం, ఉత్పత్తి చేయబడిన పదార్ధం మధ్య సంబంధం పదార్ధం, సమాన చిహ్నాన్ని సూచించే రసాయన సూత్రాన్ని ఉపయోగించి వ్యక్తీకరించబడుతుంది. ఎడమ వైపున ప్రతిచర్య, కుడి వైపున ఉత్పత్తి ఉంటుంది. ప్రతిచర్య యొక్క పరమాణుతను ప్రయోగాత్మకంగా నిర్ణయించడం సాధ్యపడుతుంది.[2] ప్రతిచర్యను అనేకసార్లు నిర్వహించడం ద్వారా, ప్రతిసారీ ప్రతిచర్యల సాంద్రతలను మార్చడం ద్వారా, ప్రతిచర్యను ఉత్తమంగా సూచించే సమీకరణాన్ని కనుగొనవచ్చు. ప్రతి ప్రతిచర్యకు దాని స్వంత లక్షణ సమతౌల్య బిందువు ఉంటుంది, దీనిని సమతౌల్య స్థిరాంకం అనే సంఖ్యతో వర్ణించవచ్చు.
నాలుగు ప్రాథమిక రకాలు
[మార్చు]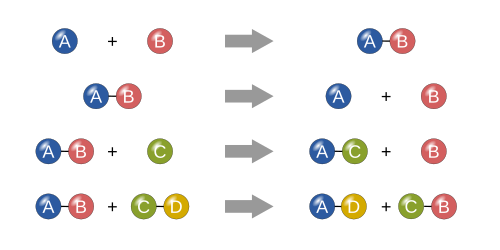
మూలాలు
[మార్చు]- ↑ "Chemical reactions | Chemistry of life | Biology (article)". Khan Academy (in ఇంగ్లీష్). Archived from the original on 2020-07-02. Retrieved 2020-07-02.
- ↑ ekShiksha. "రసాయన, సమీకరణాల | Chemical Reaction | CBSE | Class 10 | ekShiksha". www.ekshiksha.org.in (in ఇంగ్లీష్). Archived from the original on 2020-07-03. Retrieved 2020-07-02.
