నీటి అయనీకరణము

నీటి స్వీయ-అయనీకరణం ( నీటి అయనీకరణ ) అనేది స్వచ్ఛమైన నీటిలో లేదా జల ద్రావణంలో అయనీకరణ చర్య. దీనిలో నీటి అణువు H 2 O ప్రోటాన్లను కోల్పోయి (దాని హైడ్రోజన్ పరంఆణువులో ఒక కేంద్రకాన్ని కోల్పోతుంది) ఒక హైడ్రాక్సైడ్ అయాన్ OH - ఏర్పడుతుంది. హైడ్రోజన్ కేంద్రకం H + వెంటనే మరొక నీటి అణువుకు ప్రోటాన్ను అందించి హైడ్రోనియం, H 3 O + ను ఏర్పరుస్తుంది. ఇది ఆటోప్రొటోలిసిస్కు ఉదాహరణ, నీటి యొక్క ద్విస్వభావయుత ధర్మానికి ఉదాహరణగా చెప్పుకోవచ్చు.
సమతౌల్య స్థిరాంకం
[మార్చు]
రసాయనికంగా స్వచ్ఛమైన నీటి విద్యుత్ వాహకత 0.055 µ S / cm ఉంటుంది.
స్వాంటె అర్హీనియస్ సిద్ధాంతాల ప్రకారం, ఇది అయాన్ల ఉనికి కారణంగా ఉండాలి. నీటి స్వీయ-అయనీకరణ ప్రతిచర్య ద్వారా అయాన్లు ఉత్పత్తి అవుతాయి.
- H 2 O + H 2 O ⇌ H 3 O + + OH -
ఈ సమతుల్యత స్వచ్ఛమైన నీరు, ఏదైనా సజల ద్రావణానికి వర్తిస్తుంది.
గాఢతలకు బదులుగా a రసాయన చర్యలతో వివరించడానికి నీటి అయనీకరణం కోసం ఉష్ణగతిక సమతౌల్య స్థిరాంకం:
ఇది సాంప్రదాయ ఉష్ణాగతిక సమతౌల్య స్థిరాంకానికి సంఖ్యాపరంగా సమానం:
ఒకే ఉష్ణోగ్రత, పీడనం వద్ద H +, H 3 O + యొక్క రసాయన సామర్థ్యాల మొత్తం సాధారణంగా H 2 O రసాయన సామర్థ్యానికి రెండు రెట్లు అవుతుందని భావిస్తున్నారు[1].
చాలా ఆమ్ల-క్షార ద్రావణాలు సాధారణంగా విలీనంగా ఉండటం వలన , నీటి చర్య సాధారణంగా ఒకటికి సమానమైనవిగా అంచనా వేయబడతాయి. ఇది నీటి అయానిక లబ్దన్ని వ్యక్తీకరించడానికి ఉపాయోగపడుతుంది:
విలీన జల ద్రావణాలలో, ద్రావిత కణాల చర్యలు వాటి గాఢతకు సుమారు సమానంగా ఉంటాయి. అందువలన్న అయనీకరన స్థిరాంకం, విఘటన స్థిరాంకం, స్వీయ-అయనీకరణ స్థిరాంకం, నీటి అయానిక లబ్ద స్థిరాంకం లేదా నీటి అయానిక లబ్దం లను Kw తో సూచిస్తారు.
ఇక్కడ [H 3 O + ] అనేది హైడ్రోజన్ లేదా హైడ్రోనియం అయాన్ గాఢత (≈ మోలార్ గాఢత)[2] ఇక్కడ సమతాస్థితి స్థిరాంకం గాఢతల (చర్యలకు విరుద్ధంగా) లబ్దంగా రాస్తే విలువకు ఆయానిక సామర్థం, ఇతర కారకాల ఆధారంగా దిద్దిబాట్లు తప్పనిసరిగా చేయాలి. (క్రింద చూడండి). [3]
25 ° C, శూన్య ఆయానిక సామర్థ్యం వద్ద K w విలువ 1.0×10−14 కు సమానం. అన్ని సమతౌల్య స్థిరాంకాల మాదిరిగా, ఈ ఫలితం ప్రమాణం లేనిది అని గమనించండి. ఎందుకంటే వాస్తవానికి గాఢత అనేది సాపేక్షంగ ప్రామాణిక స్థితిలో ఉంటుంది. H +, OH - రెండూ 1 మోలాల్ (లేదా మోలార్) గా నిర్వచించబడతాయి.
చాలా ఆచరణాత్మక ప్రయోజనాల కోసం, పరిసర ఉష్ణోగ్రత, పీడనం వద్ద మోలాల్, మోలార్ గాఢతలు సమానంగా ఉంటాయి. మోలాల్ గాడత స్కేల్ దాని గాఢతా విలువలను తెలియజేస్తుంది. ఇది ఉష్ణోగ్రత లేదా పీడన మార్పులతో సాంద్రత మార్పులకు కారణమవుతుంది. అందువల్ల ఇది ఖచ్చితమైన లేదా పరిసరం కాని సందర్భాలలో ఉపయోగిస్తారు. ఉదా: సముద్రపు నీటి కోసం, [2] లేదా థర్మల్ పవర్ ప్లాంట్లలో పెరిగిన ఉష్ణోగ్రతలలో ఉపయోగించే స్కేల్.
మనం p K w −log 10 K w (ఇది సుమారు 25 ° C వద్ద 14) గా కూడా నిర్వచించవచ్చు.
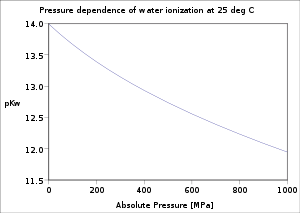
ఉష్ణోగ్రత, పీడనం, అయానిక సామర్థ్యం మీద ఆధారపడటం
[మార్చు] |
 |
 |
ఉష్ణోగ్రత, పీడనంపై నీటి అయనీకరణం యొక్క ఆధారపడటం పూర్తిగా పరిశోధించబడింది. [4] ఉష్ణోగ్రత పెరిగేకొద్దీ p K w విలువ తగ్గుతుంది. మంచు ద్రవీభవన స్థానం నుండి c వద్ద కనిష్టంగా 250 ° C వరకు తగ్గి తరువాత నీటి సందిగ్థ ఉష్ణోగ్రత 374 °C వరకు పెరుగుతుంది. ఇది పీడనం పెరిగితే తగ్గుతుంది.
| ఉష్ణోగ్రత | పీడనం | p K w |
|---|---|---|
| 0 ° C | 0.10 MPa | 14.95 |
| 25 ° C | 0.10 MPa | 13.99 |
| 50 ° C | 0.10 MPa | 13,26 |
| 75 ° C | 0.10 MPa | 12,70 |
| 100 ° C | 0.10 MPa | 12.25 |
| 150 ° C | 0.47 MPa | 11.64 |
| 200 ° C | 1.5 MPa | 11.31 |
| 250 ° C | 4.0 MPa | 11.20 |
| 300 ° C | 8.7 MPa | 11.34 |
| 350 ° C | 17 MPa | 11,92 |
విద్యుద్విశ్లేష్య ద్రావణాలతో, p K w యొక్క విలువ విద్యుద్విశ్లేష్యం అయానిక సామర్థ్యం మీద ఆధారపడి ఉంటుంది.
1: 1 విద్యుద్విశ్లేష్యానికి సోడియం క్లోరైడ్ విలువలు విలక్షణమైనవి. 1: 2 విద్యుద్విశ్లేష్యాలతో, MX 2, p K w పెరుగుతున్న అయానిక సామర్థ్యంతో తగ్గుతుంది. [6]
మూలాలు
[మార్చు]- ↑ "Release on the Ionization Constant of H2O" (PDF). The International Association for the Properties of Water and Steam. August 2007.
- ↑ 2.0 2.1 Stumm, Werner; Morgan, James (1996). Aquatic Chemistry. Chemical Equilibria and Rates in Natural Waters (3rd ed.). John Wiley & Sons, Inc. ISBN 9780471511847.
- ↑ Harned, H. S.; Owen, B. B. (1958). The Physical Chemistry of Electrolytic Solutions (3rd ed.). New York: Reinhold. pp. 635.
- ↑ International Association for the Properties of Water and Steam (IAPWS)
- ↑ Bandura, Andrei V.; Lvov, Serguei N. (2006). "The Ionization Constant of Water over Wide Ranges of Temperature and Density" (PDF). Journal of Physical and Chemical Reference Data. 35 (1): 15–30. Bibcode:2006JPCRD..35...15B. doi:10.1063/1.1928231. Archived from the original (PDF) on 2013-05-12. Retrieved 2020-01-17.
- ↑ Harned, H. S.; Owen, B. B. (1958). The Physical Chemistry of Electrolytic Solutions (3rd ed.). New York: Reinhold. pp. 634–649, 752–754.
బాహ్య లింకులు
[మార్చు]- జనరల్ కెమిస్ట్రీ - నీటి ఆటోయోనైజేషన్



![{\displaystyle K_{\rm {w}}=[{\rm {H_{3}O^{+}}}][{\rm {OH^{-}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86dca39006c4f875cacc14395c7ff6e38a09d990)

