రసాయన గతి శాస్త్రం
This పేజీకి ఏ ఇతర పేజీల నుండి లింకులు లేకపోవడం చేత ఇదొక అనాథ పేజీగా మిగిలిపోయింది. |
రసాయన గతిశాస్త్రం (ఆంగ్లం: Chemical kinetics) రసాయన చర్యల రేట్ల యొక్క అధ్యయనం. రసాయన గతిశాస్త్రం వివిధ ప్రయోగాత్మక పరిస్థితులు రసాయన చర్యల వేగాన్ని ఎలా ప్రభావితం చేస్తాయో, చర్యావిధానం గురించి, ట్రాన్సిషన్ స్టేట్స్ గురించి సమాచారం అందిస్తుంది. అలాగే రసాయన చర్యల యొక్క లక్షణాలను వివరించడానికి గణిత నమూనాలను నిర్మించడానికి ఉపయోగపడుతుంది. 1864 లో పీటర్ వాజ్, కాతో గుల్ద్బెర్గ్ మాస్ యాక్షన్ చట్టం ద్వారా రసాయన చర్యల యొక్క అభివృద్ధికి తోడ్పడ్డారు. మాస్ యాక్షన్ చట్టం ఏం చెబుతుందంటే: రసాయన చర్య యొక్క వేగం పాల్గొనే క్రియాజనకాల గాఢత లభ్దమ్ పై ఆధారపడి ఉంటుంది.

రసాయన గతిశాస్త్రం ముఖ్యంగా రసాయన చర్యల యొక్క రేట్లను ప్రయోగాత్మకంగా కనుక్కోవడానికి, వాటి నుండి రేటు నియమాలు, రేటు స్థిరాంకాలు వ్యుత్పత్తి చేయడానికి ఉపయోగపడుతుంది.సున్నా, మొదటి, ద్వితీయ క్రమాంకచర్యలకు సులువైన రేటు నియమాలు ఉంటాయి. వరస ప్రతిచర్యల్లో రేటు నియంత్రణ చర్య మొత్తం చర్య యొక్క రేటును నియంత్రిస్తుంది.ప్రథమ క్రమాంకం చర్యల్లో స్టడీ స్టేట్ రేటు నియమాలను వ్యుత్పత్తి చేయడానికి ఉపయోగపడుతుంది.ఉత్తేజిత శక్తిని ప్రయోగాత్మకంగా అర్హీనియస్, ఐరింగ్ సమీకరనాలను ఉపయోగించి కనుక్కోవచ్చును.చర్య యొక్క వేగాన్ని ముఖ్యంగా ప్రభావితం చేసే అంశాలు: క్రియాజనకాల భౌతిక స్థితి, క్రియాజనకాల గాఢతలు, చర్యా ఉష్ణోగ్రత, చర్యలో ఉత్ప్రేరకం వాడింది, లేనిది అనే అంశం.
చర్య రేటు ను ప్రభావితం చేసే అంశాలు
[మార్చు]క్రియాజనకాల స్వభావం
[మార్చు]చర్య యొక్క రేటు పదార్థాల మీద ఆధారపడుతుంది.ఆమ్ల క్షార చర్యలు, లవణాల యొక్క తయారీ, ఆయానిక చర్యలు వేగమైన చర్యలు.సమయోజనీయ బంధాలు ఏర్పడినప్పుడు, పెద్దవైన అణువులు ఏర్పడినప్పుడు చర్యల యొక్క వేగం తక్కువగా ఉంటుంది.క్రియాజనకల స్వభావం, వాటిలో ఉండే బంధాలు రేటును చాలా ప్రభావితం చేస్తాయి.
భౌతిక స్థితి
[మార్చు]క్రియాజనకం యొక్క భౌతికస్థితి (ఘనం, ద్రవం లేదా బాష్పం) చర్య రేటును ప్రభావితం చేస్తుంది.అన్ని క్రియజనకాలు ఒకే ప్రావస్థమ్ లో ఉన్నప్పుడు ఉష్ణ చలనం వాటిని దగ్గర చేస్తుంది.కానీ వేరు వేరు ప్రావస్థమ్ లలో ఉన్నప్పుడు చర్య క్రియాజనకాల యొక్క స్పర్శ జ్ఞాన వైశాల్యం దగ్గరే జరుగుతుంది.కాబట్టి ఒక క్రియాజనకం యొక్క వైశాల్యం/పరిమాణం ఎంత ఎక్కువగా ఉంటే ఆ చర్య అంతా వేగంగా ఉంటుంది.ఉదాహరణకు నిప్పు పెట్టడానికి చిన్న కొమ్మలు, చెక్క ముక్కలు ఉపయోగిస్తాము కానీ చెక్క మొద్దులను ఉపయోగించము కదా!కర్బన రసాయన చర్యల్లో "on water " చర్యలు తప్ప అన్ని సజాతీయమైన చర్యలు విజాతీయమైన చర్యల కంటే వేగవంతమైనవి.
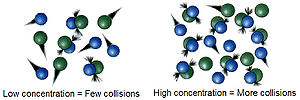
క్రియాజనకాల గాఢతలు
[మార్చు]రసాయన చర్యలు క్రియాజనకల అణువుల మధ్య జరిగే అభిఘాతాల ద్వారా జరుగుతాయి.అణువుల మధ్య జరిగే తాడనాల సంఖ్య వాటి గాఢతల మీద ఆధారపడి ఉంటుంది.గాఢత ఎంత ఎక్కువ ఉంటే వాటి మధ్య అభిఘాతాల సంఖ్య కూడా ఎక్కువగా ఉంటుంది.కాబట్టి క్రియాజనకాల యొక్క గాఢతలు ఎక్కువగా ఉంటే చర్యల యొక్క వేగం కూడా ఎక్కువగా ఉంటుంది.అలాగే గాఢతలు తక్కువగా ఉంటే వేగం కూడా తక్కువగా ఉంటుంది.ఉదాహరణకు గాలిలో (20% ప్రాణవాయువు) జరిగే దహనక్రియ శ్రేస్టమైన ప్రాణవాయువులో వేగముగా జరుగుతుంది.
ఉష్ణోగ్రత
[మార్చు]చర్యల యొక్క వేగము పైన ఉష్ణోగ్రత యొక్క ప్రభావము ఎక్కువగా ఉంటుంది.ఎక్కువ ఉష్ణోగ్రతలో ఉండే అణువులకు ఎక్కువ శక్తి ఉంటుంది. ఎక్కువ ఉష్ణోగ్రతలో అణువుల మధ్య అభిగాతల సంఖ్య ఎక్కువ ఉన్నప్పటికీ చర్య వేగము కొంతవరకే పెరుగుతుంది.
ఉష్ణోగ్రత 10 డిగ్రీలు పెరిగితే చర్య యొక్క వేగం రెడింతలు అవ్వవలసిన అవసరం లేదు.
సాధారణంగా జీవ వ్యవస్థల్లో ఉష్ణోగ్రతా గుణాంకం 15 నుండి 2.5 మధ్యలో ఉంటుంది.
ఉత్ప్రేరకం
[మార్చు]
ఉత్ప్రేరకం రసాయన చర్య యొక్క వేగాన్ని పెంచుతుంది కానీ చర్యలో వినియోగం కాదు.చర్యా మార్గాన్ని మార్చడం ద్వారా ఇది చర్య వేగాన్ని పెంచుతుంది.ఉత్తేజిత శక్తి విలువ తక్కువ ఉండే వేరొక మార్గం ద్వారా చర్య జరుగుంటుంది."auto catalysis"లో క్రియాజన్యమే ఉత్ప్రేరకం అవుతుంది.ఉత్ప్రేరకాలుగా పనిచేసే ప్రోటీన్లను ఎంజైమ్లు అని అంటారు.మైకేలూయిస్ -మెంటెన్ గతిశాస్త్రం ఎంజైమ్లు ఉండే చర్యల గురించి వివరిస్తుంది.ఉత్ప్రేరకం సమతా స్థితిని ప్రభావితం చేయదు.అది పురోగామి ప్రక్రియను, తిరోగామి ప్రక్రియను సమానంగా వేగవంతం చేస్తుంది.
ద్రవనాలను కలపడం కూడా చర్య యొక్క వేగాన్ని పెంచుతుంది.ఇలా చేయడం ద్వారా అణువుల యొక్క గతి శక్తి పెరుగుతుంది.దీని వల్ల ఎక్కువ అభిఘాతాలు అవ్వడం వల్ల ఎక్కువ ఉత్తేజిత అభిగాతాలు అవుతాయి.
పీడనం
[మార్చు]బాష్ప చర్యలో పీడనం పెంచడం ద్వారా క్రియాజనకాల మధ్య అభిగాతాల సంఖ్య పెరుగుతుంది, కాబట్టి వేగము కూడా పెరుగుతుంది.బాష్పం యొక్క "ఆక్టివిటీ"దాని పాక్షిక పీడనం మీద ఆధారపడుతుంది.దీనిని ద్రావణం గాఢత పెంచడం ద్వారా ఏర్పడే ప్రభావంతో పోల్చవచ్చు.
పీడనం మార్చడం ద్వారా రేటు స్థిరాంకం కూడా మారవచ్చు. ఎక్కువ ఉష్ణోగ్రతల బాష్పచర్యల్లో జాడ వాయువు కలపడం ద్వారా రేటు స్థిరాంకాలు, క్రియాజన్యాలు మారవచ్చు.ఇలాంటివి ఉష్ణగ్రాహక చర్యలు, ఉష్ణమోచక చర్యలు వేడి బదిలీ కంటే వేగవంతం అవ్వడం వల్ల జరుగుతాయి.పీడనం పెంచడం ద్వారా క్రియాజనకాలు, మిగిలిన పదార్థాల మధ్య వేడి బదిలీ వేగం కూడా పెరుగుతుంది .
కండేన్సేడ్ ఫేస్ రేటు స్థిరాంకాలు కూడా ఎక్కువ పీడనం వల్ల ప్రభావితం అవుతాయి.ఇది డైమండ్ అన్విల్స్ ద్వారా వివరించవచ్చు. ప్రేషర్ జంప్ ద్వారా గతి శాస్త్రాన్ని అధ్యయనం చేయవచ్చు.
సమతాస్థితి
[మార్చు]గతి శాస్త్రం ద్వారా చర్య యొక్క రేటు గురించి తెలుస్తుంది, ఉష్ణగతిక శాస్త్రం ఒక రసాయన చర్య అయత్ణీకృతంగా జరుగుతుందా లేదా అనే విషయం తెలుపుతుంది.ద్విగత చర్యలో పురోగామి, తిరోగామి చర్యల యొక్క వేగలు సమానంగా ఉన్నప్పుడూ సమతాస్థితి ఏర్పడుతుంది.క్రియాజనకాల, క్రియాజన్యాల గాఢతలలో ఏ మార్పు ఉండదు.ఉదాహరణకు, హేబర్-బాష్ ప్రక్రియ .ఇందులో నైట్రోజెన్, హైడ్రోజెన్ వాయువులతో అమ్మోనియా వాయువుని వ్యుత్పత్తి చేస్తారు.బెలౌసోవ్-జ్హాబోతింస్కీ ప్రక్రియ వల్ల పదార్థాల గాఢతలు చాలా సేపటివరకు మారి చివరకు సమతాస్థితికి వస్తుంది.
స్వేచ్చా శక్తి
[మార్చు]స్వేచ్ఛా శక్తి మార్పు చర్య జరుగుంటుందో లేదో తెలుపుతుంది కానీ గతి శాస్త్రం దాని వేగాన్ని తెలుపుతుంది.చర్య ఉష్ణమోచకం అయ్యుండి, దాని ఎన్త్రోపి మార్పు ఎక్కువ ఉన్నప్పటికీ ఒకవేళ అది నెమ్మది చర్య ఐనచో ఆ చర్య జరగదు.ఒకవేళ ఒక క్రియాజనకం రెండు క్రియాజన్యాలను ఉత్పత్తి చేసినచో సాధారణంగా ఉష్ణగతికంగా స్థిరంగా ఉన్నదే వస్తుంది. (కొన్ని పరిస్థితితుల్లో తప్ప).స్వేఛా శక్తి తెలుసుకోవటం ద్వారా చర్య యొక్క రేటు స్థిరాంకాలు కనుక్కోవచ్చు.
గతి ఐసోటోప్ ప్రభావం అనగా ఒక క్రియాజనకాన్నిబదులు దాని ఐసోటోప్ పెట్టడం వలన చర్య యొక్క రేటులో వచ్చే మార్పు.
ఉపయోగాలు
[మార్చు]గతి శాస్త్రాన్ని వివరించే గణిత నమూనాలు రసాయన శాస్త్రవేత్తలను, ఇంజనీర్లను వాటిని బాగా అర్థం చేసుకుని, పదార్థాల విఘటనం, సూక్షం జీవుల పెరుగుదల, ఓజోన్ విఘటనం వంటి రసాయన ప్రక్రియలను వివరించడానికి ఉపయోగపడ్డాయి.ఈ నమూనాలు రసాయన రియాక్టర్లను రూపొందించడానికి, క్రియాజన్యాలను వేరు చేయడానికి, ప్రకృతికి హాని కలిగించే పదార్థాలను వేరు చేయడానికి ఉపయోగించవచ్చు.ఉదాహరణకు, కర్బన పదార్థాల ఉత్ప్రేరక క్రాకింగ్ లో గతి శాస్త్రాన్ని ఉపయోగించి ఎక్కువ క్రియాజన్యం పొందగలిగే ఉష్ణోగ్రత, పీడనం కనుక్కోవచ్చును.గతిశాస్త్రం రసాయన శాస్త్రం యొక్క మూలం.
