కాపర్(I) క్లోరైడ్
| |

| |
| పేర్లు | |
|---|---|
| IUPAC నామము
Copper(I) chloride
| |
| ఇతర పేర్లు
Cuprous chloride
| |
| గుర్తింపు విషయాలు | |
| సి.ఎ.ఎస్. సంఖ్య | [7758-89-6] |
| పబ్ కెమ్ | 62652 |
| యూరోపియన్ కమిషన్ సంఖ్య | 231-842-9 |
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:53472 |
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | GL6990000 |
| SMILES | Cl[Cu] |
| |
| ధర్మములు | |
| CuCl | |
| మోలార్ ద్రవ్యరాశి | 98.999 g/mol |
| స్వరూపం | white powder, slightly green from oxidized impurities |
| సాంద్రత | 4.145 g/cm3 |
| ద్రవీభవన స్థానం | 426 °C (799 °F; 699 K) |
| బాష్పీభవన స్థానం | 1,490 °C (2,710 °F; 1,760 K) (decomposes) |
| 0.0062 g/100 mL (20 °C) | |
| Solubility product, Ksp | 1.72 x 10−7 |
| ద్రావణీయత | insoluble in ethanol acetone; soluble in concentrated HCl, NH4OH |
| వక్రీభవన గుణకం (nD) | 1.930[1] |
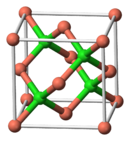
| నిర్మాణం | |
స్ఫటిక నిర్మాణం
|
Zinc blende structure |
| ప్రమాదాలు | |
| భద్రత సమాచార పత్రము | JT Baker |
| ఇ.యు.వర్గీకరణ | {{{value}}} |
| R-పదబంధాలు | R22, R50/53 |
| S-పదబంధాలు | (S2), మూస:S22, S60, S61 |
| జ్వలన స్థానం | {{{value}}} |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
140 mg/kg |
| సంబంధిత సమ్మేళనాలు | |
| ఇతరఅయాన్లు | {{{value}}} |
ఇతర కాటయాన్లు
|
Copper(II) chloride Silver(I) chloride |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
కాపర్(I)క్లోరైడ్ అనునది ఒక రసాయన సమ్మేళనం.ఇది ఒక అకర్బన రసాయన సంయోగపదార్థం. కాపర్(I)క్లోరైడును సాధారణంగా కుప్రస్ క్లోరైడ్ అనికూడా పిలుస్తారు.రాగి ధాతువు యొక్క కనిష్ఠ క్లోరైడ్ సంయోగ పదార్థం ఇది. కాపర్(I)క్లోరైడ్ నీటితో అల్పతమ ద్రావణీయత కలిగిఉన్నది. గాఢ హైడ్రోక్లోరిక్ ఆమ్లంలో కాపర్ (I)క్లోరైడు బాగా కరుగుతుంది. కాపర్(I)క్లోరైడ్లో కాపర్(II)క్లోరైడ్ మలినంగా ఉన్నప్పుడు కాపర్ (I)క్లోరైడ్ పచ్చరంగులో కనపడును. ఈ సమ్మెళనపదార్థం యొక్క రసాయన సంకేత పదం CuCl.
చరిత్ర[మార్చు]
17 వశతాబ్ది మధ్య కాలంలో రాబర్ట్ బాయల్(Robert Boyle)అను శాస్త్రవేత్త, మెర్క్యురీ(II)క్లోరైడ్,, రాగి లోహాన్ని సంయోగపరచి మొదటగా కాపర్(I)క్లోరైడ్ను ఉత్పత్తి చేసాడు.
- HgCl2 + 2Cu → 2CuCl + Hg
సా.శ.1799 లో జె.ఎల్.ప్రౌస్ట్ రాగి యొక్క రెండురకాల క్లోరైడ్ సమ్మేళనంల గురించి విపులీకరించాడు.ఇతను కాపర్ డైక్లోరైడ్ (CuCl2)ను గాలి లేని వాతావరణంలో(గాలి అభావస్థితిలో) ఎరుపెక్కునట్లు వేడిచెయ్యడంద్వారా,సమ్మేళన పదార్థంలోని సగం క్లోరిన్ను విడుదల/వియోగం చెందునట్లు చేసి,మిగిలిన శేష కాపర్ డైక్లోరైడ్ను నీటితో కడిగి,కరిగించి తొలగించడం ద్వారా కాపర్ క్లోరైడ్ను ఉత్పత్తి చేసాడు.
హేమ్పెల్ వాయు పరికరం(Hempel's gas apparatus)ద్వారా వాయువులలోని కార్బన్ మొనాక్సైడ్ను గుర్తించుటకై చెయ్యు విశ్లేషణలో కాపర్ క్లోరైడ్ను ఉపయోగించెడివారు.కోల్గ్యాస్ను విస్తృతంగా వేడి చెయ్యుటకు, దీపాలను వెలిగించుట ఉపయోగించిన 19వ శతాబ్ది, 20వ శతాబ్ది మొదటికాలంలో, ఈ హేమ్పెల్ వాయుపరికరం ద్వారా కార్బన్ మొనాక్సైడ్ వాయువు శాతాన్ని లెక్కించేవారు.
భౌతిక ధర్మాలు[మార్చు]
కాపర్(I)క్లోరైడ్ తెల్లగా ఘన పొడిరూపంలో ఉండును. మలినాలు ఉన్నప్పుడు పచ్చగా ఉండును. కాపర్(I)క్లోరైడ్ యొక్క అణుభారం 98.999 గ్రాములు/మోల్. కాపర్(I)క్లోరైడ్ సంయోగపదార్థం యొక్కసాంద్రత 4.145 గ్రాములు/సెం.మీ3.ఈ సంయోగ పదార్థం యొక్క ద్రవీభవన స్థానం 426 °C (799 °F; 699K),, ఈ సమ్మేళనపదార్థం యొక్క బాష్పీభవన స్థానం 1,490 °C (2,710 °F; 1,760K),ఈ ఉష్ణోగ్రత వద్ద ఈ రసాయనపదార్థం వియోగం చెందును. కాపర్(I)క్లోరైడ్ యొక్క వక్రీభవన సూచిక 1.930. కాపర్(I)క్లోరైడ్ దహనశీలి కాదు.
రసాయన ధర్మాలు[మార్చు]
కాపర్ (I)క్లోరైడ్ గాలిలో పాక్షికముగా ఆక్సీకరణ చెందును.కాపర్ (I)క్లోరైడ్ ఒక లేవిస్ ఆమ్లం(Lewis acid).కఠిన-మృదు ఆమ్ల-క్షార ప్రతిపాదన(Hard-Soft Acid-Base concept)ప్రకారం కాపర్(I)క్లోరైడ్ మృదు/సాధు లేవిస్ ఆమ్లం, అందుచే సాధు లేవిస్ క్షారాలతో స్థిరమైన ట్రైఫినైల్ ఫాస్ఫైన్ ( triphenylphosphine) వంటి సంక్లిష్ట సంయోగాలను ఏర్పరచును.
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
కాపర్ క్లోరైడ్ నీటిలో కరుగానప్పటికి, తగిన అయాన్ దాతృత్వ అణువులున్న సజల ద్రావణులలో కాపర్(I)క్లోరైడ్ కరుగుతుంది. హాలైడ్ అయానులతో సంక్లిష్ట సంయోగ పదార్థాలను ఏర్పరచును.ఉదాహరణకు గాఢ హైడ్రోక్లోరిక్ ఆమ్లంతో చర్యవలన H3O+ CuCl2−ను ఏర్పరచును.
అలాగే సైనైడ్( CN−),థయోసల్ఫెట్ S2O32−,, అమ్మోనియా(NH3)లతో చర్యవలన సంబంధిత రసాయనపదార్థాల సంక్లిష్ట సంయోగ పదార్థాలను ఏర్పరచును.
హైడ్రో క్లోరిక్ ఆమ్లం, ఆమ్మోనియా ద్రావణాలలోని కాపర్క్లోరైడ్ కార్బన్మొనాక్సైడ్ను గ్రహించి, రంగులేని క్లోరైడ్ బ్రిడ్జేడ్ డైమర్[CuCl(CO)]2వంటి సంక్లిష్టాలను ఏర్పరచును.అలాగే కాపర్ క్లోరైడ్ కలిగిన హైడ్రోక్లోరిక్ ఆమ్లద్రావణం అసిటిలిన్వాయువుతో చర్య వలన [CuCl(C2H2)] ఏర్పరచును .అమ్మోనికల్ ద్రావణాన్ని కలిగిన కాపర్ క్లోరైడ్అసిటైలిన్(acetylene)తో రసాయనిక చర్య వలన కాపర్(I)అసిటేలిడ్(Cu2C2)ను ఏర్పరచును.
ఉపయోగాలు[మార్చు]
కాపర్(I)క్లోరైడును ఎక్కువగా కాపర్ ఆక్సీక్లోరైడ్ అను శిలీంధ్రనాశనిని ఉత్పత్తి చెయ్యుటకు పుర్వగామి (precursor) గా ఉపయోగిస్తారు. ఈ విధానానికై comproportionation ద్వారా సజల కాపర్ (I) ద్రవాణాన్ని తయారుచేసి,దానిని గాలితో ఆక్సికరించడం వలన కాపర్ ఆక్సీక్లోరైడ్ను ఉత్పత్తి చెయ్యుదురు.
- Cu + CuCl2 → 2 CuCl
- 6CuCl + 3/2 O2 + 3 H2O → 2 Cu3Cl2(OH)4 + CuCl2
వివిధ రకాల సేంద్రియ రసాయన చర్యలను కాపర్(I)క్లోరైడ్ ఉత్ప్రేకరిస్తుంది(catalyzes).
సేంద్రియ పదార్థాల సంశ్లేషణ[మార్చు]
గట్టర్మాన్ –కోచ్ రియాక్షన్ (Gatterman-Koch reaction)విధానంలో కార్బన్ మొనాక్సైడ్,అల్యూమినియం క్లోరైడ్,హైడ్రోజన్ క్లోరైడ్లతో కాపర్(I)క్లోరైడును ఉపయోగించి బేంజాల్డిహైడ్స్ను ఉత్పత్తి చెయ్యుదురు. శాండీ మేయర్ రియాక్షన్ ప్రక్రియలో అరెన్డైఅజోనియం(arenediazonium)లవణం కాపర్(I)క్లోరైడుతో చర్యజరపడం వలన అరైల్ క్లోరైడ్ ఏర్పడును.
ఈ విధానం విస్తృతంఅయినది. మంచిఉత్పత్తి ఫలితాలను ఇస్తుంది.
పాలిమర్ రసాయన శాస్త్రం[మార్చు]
ఆటమ్ ట్రాన్స్ఫర్ రాడికల్ పాలిమేరిజైసన్ (ATRP)ప్రక్రియలో కాపర్ క్లోరైడ్ను ఉత్ప్రేరకంగా ఉపయోగిస్తారు.
రక్షణ[మార్చు]
వాతావరణానికి హానికరం
ఇవికూడా చూడండి[మార్చు]
చిత్రమాలిక[మార్చు]
-
రాగి తీగెమీదనున్న తెల్లని కాపర్(I) క్లోరైడ్ స్పటికాలు
-
గాలిలో పాక్షికంగా ఆక్సీకరణ చెందిన కాపర్(I) క్లోరైడ్,
మూలాలు-ఆధారాలు[మార్చు]
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8


