అమ్మోనియా
| |||

| |||
| పేర్లు | |||
|---|---|---|---|
| IUPAC నామము
Azane
| |||
| ఇతర పేర్లు
Hydrogen nitride
Trihydrogen nitride | |||
| గుర్తింపు విషయాలు | |||
| సి.ఎ.ఎస్. సంఖ్య | [7664-41-7] | ||
| పబ్ కెమ్ | 222 | ||
| యూరోపియన్ కమిషన్ సంఖ్య | 231-635-3 | ||
| కెగ్ | D02916 | ||
| వైద్య విషయ శీర్షిక | Ammonia | ||
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:16134 | ||
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | BO0875000 | ||
| SMILES | N | ||
| |||
| బైల్ స్టెయిన్ సూచిక | 3587154 | ||
| జి.మెలిన్ సూచిక | 79 | ||
| 3DMet | B00004 | ||
| ధర్మములు | |||
| NH3 | |||
| మోలార్ ద్రవ్యరాశి | 17.031 g/mol | ||
| స్వరూపం | Colourless gas | ||
| వాసన | strong pungent odour | ||
| సాంద్రత | 0.86 kg/m3 (1.013 bar at boiling point) 0.769 kg/m3 (STP)[1] | ||
| ద్రవీభవన స్థానం | −77.73 °C (−107.91 °F; 195.42 K) | ||
| బాష్పీభవన స్థానం | −33.34 °C (−28.01 °F; 239.81 K) | ||
| 47% w/w (0 °C) 31% w/w (25 °C) 18% w/w (50 °C)[4] | |||
| ద్రావణీయత | soluble in chloroform, ether, ethanol, methanol | ||
| బాష్ప పీడనం | 8573 h Pa | ||
| ఆమ్లత్వం (pKa) | 32.5 (−33 °C),[5] 10.5 (DMSO) | ||
| Basicity (pKb) | 4.75 | ||
| వక్రీభవన గుణకం (nD) | 1.3327 | ||
| నిర్మాణం | |||
| C3v | |||
| Trigonal pyramid | |||
ద్విధృవ చలనం
|
1.42 D | ||
| ఉష్ణగతిక రసాయన శాస్త్రము | |||
| నిర్మాణము మారుటకు కావాల్సిన ప్రామాణిక ఎంథ్రఫీ ΔfH |
−46 kJ·mol−1[6] | ||
| ప్రామాణిక మోలార్ ఇంథ్రఫీ S |
193 J·mol−1·K−1[6] | ||
| ప్రమాదాలు | |||
| భద్రత సమాచార పత్రము | ICSC 0414 (anhydrous) | ||
| జి.హెచ్.ఎస్.పటచిత్రాలు |     [7] [7]
| ||
| జి.హెచ్.ఎస్.ప్రమాద ప్రకటనలు | H221, H280, H314, H331, H400[7] | ||
| GHS precautionary statements | P210, P261, P273, P280, P305+351+338, P310[7] | ||
| ఇ.యు.వర్గీకరణ | {{{value}}} | ||
| R-పదబంధాలు | R10, R23, R34, R50 | ||
| S-పదబంధాలు | (S1/2), S9, S16, S26, S36/37/39, S45, S61 | ||
| జ్వలన స్థానం | {{{value}}} | ||
స్వయం జ్వలన
ఉష్ణోగ్రత |
651 °C (1,204 °F; 924 K) | ||
| విస్ఫోటక పరిమితులు | 15–28% | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose)
|
0.015 mL/kg (human, oral) | ||
LC50 (median concentration)
|
40,300 ppm (rat, 10 min) 28595 ppm (rat, 20 min) 20300 ppm (rat, 40 min) 11590 ppm (rat, 1 hr) 7338 ppm (rat, 1 hr) 4837 ppm (mouse, 1 hr) 9859 ppm (rabbit, 1 hr) 9859 ppm (cat, 1 hr) 2000 ppm (rat, 4 hr) 4230 ppm (mouse, 1 hr)[8] | ||
| US health exposure limits (NIOSH):[9] | |||
PEL (Permissible)
|
50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) | ||
REL (Recommended)
|
TWA 25 ppm (18 mg/m3) ST 35 ppm (27 mg/m3) | ||
IDLH (Immediate danger)
|
300 ppm | ||
| సంబంధిత సమ్మేళనాలు | |||
ఇతర కాటయాన్లు
|
Phosphine Arsine Stibine | ||
| Related {{{label}}} | {{{value}}} | ||
సంబంధిత సమ్మేళనాలు
|
Ammonium hydroxide | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||

అమ్మోనియా అనునది ఒక రసాయన సమ్మేళనం. నత్రజని, హైడ్రోజన్ మూలకాల సంయోగం వలన ఈ సమ్మేళనం ఏర్పడినది. ఇది ఒక అకర్బన సమ్మేళనం.ఒక పరమాణువు నత్రజని మూడు పరమాణువులు హైడ్రోజన్తో సంయోగం చెందటం వలన అమ్మోనియా వాయువు ఏర్పడును. ఈ సమ్మేళనం యొక్క రసాయనిక ఫార్ములా NH3. ఆహారం, రసాయానిక ఎరువుల ఉత్పత్తిలో పుర్వగామిగా పనిచేయును. ప్రత్యక్షంగా, పరోక్షంగా పలుఔషదాల ఉత్పత్తిలోముఖ్య వనరుగాను,, క్లినింగ్ ఉత్పత్తులలో అమ్మోనియాను ఉపయోగిస్తారు. అమ్మోనియాను విస్తృతంగా వినియోగిస్తున్నప్పటికీ ఇది ఒక క్షారము, కొంత మేర ప్రమాదకరమైనది.
సహజమైన, స్వాభావికమైన ప్రకృతి సిద్ధమైన ఉనికి
[మార్చు]భూవాతావరణంలో అమ్మోనియా యొక్క ఉనికిని అల్పపరిమాణంలో గుర్తించారు. ప్రకృతిలో నత్రజని కలిగిన జీవులు,, మొక్కలు, చెట్లు మొదలైనవి నశించు సమయంలో అమ్మోనియా ఏర్పడి వాతావరణంలోకి విడుదల అగును. వర్షపు నీటిలో కూడా అమ్మోనియా, అమ్మోనియా లవణాలు స్వల్ప పరిమాణంలో ఉండును. అగ్ని పర్వాతాల విస్పొటన పరిసరాలలో అమ్మోనియం కార్బోనేట్ ( సాల్ అమ్మోనియాక్), అమ్మోనియా సల్ఫేట్లను గుర్తించారు.
సూర్య మండలానికి చెందిన ప్లూటో, అంగారకుడు, బృహస్పతి, శని, యురనాస్,, నెప్ట్యూన్ గ్రహాలలో కూడా అమ్మోనియా ఉనికిని గుర్తించారు. అమ్మోనియాను కలిగిన పదార్థాలను, లేదా దీనికి సమానమైన పదార్థాలను అమ్మోనియాకల్ అంటారు.
చరిత్ర
[మార్చు]రోమనులు అమ్మోనియం క్లోరైడ్ను సాల్ అమ్మోనియకస్ (sal ammoniacus :ఆమున్ లవణం)అని పిలిచేవారు.దీనిని మొదట పురాతన లిబియాలోని ఆమున్ గుడి (Greek Ἄμμων Ammon) సమీపంలో గుర్తించడం వలన ఈ పేరు పెట్టారు.సాల్ అమ్మోనియాక్ రూపంలో 8శతాబ్ది నాటికే ముస్లిం రసవేత్తలకు అమ్మోనియం పరిచయమే. దీనిని మొదటగా పెర్షియన్ రసాయనశాస్త్రవేత్త జాబీర్ ఇబిన్ హయ్యాన్ (Jābir ibn Hayyān), 13 వ శతాబ్దిలో యురోపియన్ రసవేత్తలు ప్రస్థాపించారు. మధ్యయుగంలో రంగులు అద్దేవారు ఉపయోగించి నట్లు తెలుస్తున్నది. 15 శతాబ్దిలో బాసిలియాస్ వాలెంతినస్ ( Basilius Valentinus) క్షారాలు, సాల్ అమ్మోనియా రసాయనిక చర్య వలన అమ్మోనియా ఉత్పత్తి చేసి చూపాడు.
1774 లో జోసెప్ ప్రిస్ట్లే మొదటిసారిగా అమ్మోనియా వాయువును వేరు చేసాడు.ఆయన దీనికి ఆల్కలైన్ ఎయిర్ అని నామకరణ చేసాడు. అటు పిమ్మట 11 సంవత్సరాల తరువాత క్లాడ్ లూయిస్ బెర్తోలెట్,1785 అమ్మోనియా లోని మూలకాల, ఘటకాల నిష్పత్తిని వివరించాడు.
గాలిలోని నత్రజని నుండి అమ్మోనియాను ఉత్పత్తి చెయ్యు హబెర్-బోష్ పద్ధతి (Haber–Bosch process) ఫ్రిట్జ్ హబెర్, కార్ల్ బోష్లు 1909 లో అభివృద్ధి చేసారు. ఈ ఉత్పత్తి విధానానికి యాజమాన్య హక్కు (patent)ను 1910 లో పొందారు. హబెర్-బోష్ పద్ధతిలో అమ్మోనియాను మొదటి సారిగా మొదటి ప్రపంచ యుద్ధ సమయంలో జర్మనీలో ఉత్పత్తి చేసారు. యుద్ధసమయంలో చిలే నుండి నైట్రేడుల సరాఫరా అపివెయ్యడం వలన పై పద్ధతిలో అమ్మోనియాను జర్మనీలో ఉత్పత్తి చేసారు. ఇలా ఉత్పత్తి చేసిన అమ్మోనియాను యుద్ద అవసారాలకై ప్రేలుడు వస్తువులను తయారు చేసారు.
సహజ వాయువు లభించక పూర్వం అమ్మోనియా ఉత్పత్తికి అవసరమైన హైడ్రోజన్ను నీటిని విద్యుద్వి శ్లేషన చేసి ఉత్పత్తి చేసెవారు లేదా క్లోరో ఆల్కలీని ఉపయోగించేవారు .
గుణములు-ధర్మములు
[మార్చు]అమ్మోనియా రంగులేని వాయువు. ఒకప్రత్యేకమైన ఘాటైన వాసన కలిగిఉన్నది. అమ్మోనియా గాలికన్న తేలికైనది. గాలి సాంద్రతతో పోల్చిన 0.5 89 రెట్లు ఉండును.అమ్మోనియా అణువుల మధ్య బలమైన హైడ్రోజన్ బంధ కారణంగా,అమ్మోనియా వాయువును సులభంగా ద్రవికరించవచ్చును. అమ్మోనియా −33.3 °C (−27.94 °F)వద్ద బాష్పికరిస్తుంది., −77.7 °C (−107.86 °F)వద్ద తెల్లని స్పటికాలుగా ఘనీభవిస్తుంది. అమ్మోనియాను సోడియం బైకార్బోనేట్ లేదా అసిటిక్ ఆమ్లంతో చర్య జరిపిన వాసన రహితమగును. సోడియం బైకార్బోనేట్ లేదా అసిటిక్ ఆమ్లంతో చర్యజరపడం వలన వాసన లేని అమ్మోనియం లవణాలు ఏర్పడును.
ఒక అట్మాస్ ఫియర్ వత్తిడి వద్ద అమ్మోనియా -33.34°Cవద్ద బాష్పి కరణ చెందును.కావున అమ్మోనియాను తక్కువ ఉష్ణోగ్రతలో, వత్తిడిలో నిల్వ చేసి ఉంచాలి. గృహాలలో ఉపయోగించు అమ్మోనియా లేదా అమ్మోనియం హైడ్రాక్సైడ్ అను ద్రవం అమ్మోనియా వాయువును నీటిలో కరగించి చేసింది.
ఘనస్థితి
[మార్చు]అమ్మోనియా అణువు ఘానాకృతి కలిగి ఉండును.పియర్సన్ సంకేతం cP16, స్పేస్ గ్రూప్ P213 No.198,, లాట్టిస్ స్థిరాంకం 0.5125 nm.
ద్రవ అమ్మోనియా బలమైన అయానికరణ శక్తి కలిగి ఉంది. ద్రవ అమ్మోనియా భాస్పికరణ యొక్క ప్రామాణిక ఎంథాల్ప్తిమార్పు చాలాఎక్కువ (23.35 kJ/mol, cf.నీరు 40.65 kJ/mol,మిథేన్ 8.19 kJ/mol, ఫాస్ఫైన్ 14.6 kJ/mol).
అమ్మోనియా ద్రావణి లక్షణాలు
[మార్చు]అమ్మోనియా నీటిలో కలిసిపోతుంది.సజల ద్రవం లోని అమ్మోనియాను,ద్రవాణాన్ని వేడి చెయ్యడం ద్వారా తొలగించవచ్చును. అమ్మోనియా సజల ద్రావణము క్షారగుణం కలిగి ఉండును. గరిష్ఠ గాఢత కలిగిన (సంతృప్త )అమ్మోనియా ద్రావణం సాంద్రత 0.880గ్రాములు/సెం.మీ3.
దహనం
[మార్చు]ఇంధనం-గాలి మిశ్రమ శాతం 15-25 % ఉన్నప్పుడు అమ్మోనియా దహనం చెందును.ఆక్సిజన్తో మిశ్రమ చేసి మండించిన లేత పసుపు-పచ్చ జ్వాలతో మండును. అధిక ఉష్ణోగ్రత వద్ద అమ్మోనియా, అందులోని మూలకాలుగా విడిపోవును. అమ్మోనియా గుండా క్లోరిన్ను పంపినప్పుడు జ్వలనం (Ignition) ఏర్పడును. అమ్మోనియాలో అధిక ప్రమాణంలో క్లోరిన్ కలిగి ఉన్నచో అత్యధిక ప్రేలుడు స్వభావంశక్తి కలిగిన నైట్రోజన్ ట్రై క్లోరైడ్ (NCl3) ఏర్పడును.
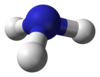
అణు ఆకృతి, నిర్మాణం
[మార్చు]అమ్మోనియా అణువు త్రికోణియ పిరమిడ్ ఆకారం కలిగి ఉండి, బంధ కోణం 106.7°కలిగి ఉండును. అమ్మోనియా అణువులో కేంద్రభాగంలోని నత్రజని/నైట్రోజన్ అణువు బయటి వలయం/ఆర్బిటాల్లో 5 ఎలక్ట్రాన్లను కలిగి ఉండి, వీటికి అదనంగా ప్రతి హైడ్రోజన్ నుండి ఒక ఎలక్ట్రాన్ను కలిగి ఉండును. అనగా అణువులో మొత్తం ఎనిమిది ఎలక్ట్రానులు లేదా 4జతల ఎలక్ట్రానులు జంటలు/జతలు చతురతల కోణంగా ఏర్పడి ఉండును. ఇందులో 3 జతల ఎలక్ట్రానులు బంధజంటగా ఏర్పడి, ఒక ఎలక్ట్రాన్ జంట ఒంటరిగా ఉండును. ఒంటరిగా ఉన్న ఈ ఎలక్ట్రాన్ జంట ఎక్కువ వికర్షణ కలిగి ఉండటంచే బంధ కోణం 109.5°బదులు 106.7° తోచతురతల కోణంగా అణువు రూపుదిద్దుకుంది.
అమ్మోనియం అణువులో నత్రజని పరమాణువు ఏకాంత ఎలక్ట్రాన్ జతను కలిగి ఉండటం వలన, అమ్మోనియాకు క్షారగుణం,, ప్రోటాన్ గ్రహీత తత్వం అబ్బినది. అమ్మోనియా అణు నిర్మాణ సౌష్టవం, అమ్మోనియాకు ధ్రువీయత ( polar) ను కల్గిస్తుంది. అమ్మోనియాకు ఉన్న ఈ ధ్రువీయత, హైడ్రోజన్ బంధాన్ని ఏర్పరచు సామర్ధ్యం, అమ్మోనియాను నీటిలో త్వరగా కరిగేటట్లు చేస్తోంది.అమ్మోనియాగా మితమైన క్షారగుణాన్ని కలిగి ఉంది. 1.0 M (మోలార్)అమ్మోనియా సజల ద్రవం యొక్క pH 11.6 .
ద్విస్వభావత/ఉభయదర్శిని
[మార్చు]అమ్మోనియా క్షార గుణంతో పాటు మితంగా అమ్ల గుణాని కలిగి ఉండటాన్ని ద్విశ్వభావత (Amphoteric)అందురు.అమ్మోనియా యొక్క క్షారగుణమే అమ్మోనియాకు ఉన్న ప్రత్యేకగుణం.అమ్మోనియా ఒక బలహీనమైన క్షారము.అమ్మోనియా, ఆమ్లాలతో సంయోగరసాయనిక చర్య జరపడం హైడ్రోక్లోరిక్ ఆమ్లంతో చర్య వలన అమ్మోనియం క్లోరైడ్ (సాల్ అమ్మోనియా), నత్రికామ్లంతో అమ్మోనియం నైట్రేట్ను ఏర్పరచును. పొడి (dry) అమ్మోనియా పొడి హైడ్రో క్లోరైడ్ తో చర్య జరుపదు,రెండింటి మధ్య చర్య కై చెమ్మ/తేమ అవసరం.
- NH3 + HCl → NH4Cl
అమ్మోనియా ఆమ్లాలతో జరపడం వలన ఏర్పడిన లవణాలను అమ్మోనియం లవణాలు అంటారు.ఈ అమ్మోనియం లవణాలు (NH4)+.అయానును కలిగి ఉండును.
అమ్మోనియా బలహీనమైన క్షార మైనప్పటికి,ఇది మితంగా ఆమ్లంగా కూడా ప్రవర్తించును.ఇది అమైడులను ( ఇవి NH2− ఆయానులను కలిగి ఉండును)ఏర్పరచును.లిథియం ద్రవ అమ్మోనియాలో కరగడం వలన లిథియం అమైడ్ ద్రావణం ఏర్పడును.
- Li + NH3 → LiNH2 + ½ H2
స్వీయ వియోజనం
[మార్చు]నీరు వలె అమ్మోనియా కూడా అణు స్వయం అయానికరణ చెందిఆమ్ల, క్షార సందిగ్ద పదార్థాలను ఏర్పరచును. ప్రామాణిక వత్తిడి, ఉష్ణోగ్రత వద్ద అమ్మోనియా K=[NH4+][NH2−] = 10−30
దహనం-రసాయన చర్యలు
[మార్చు]అమ్మోనియాను ఆక్సిజన్తో దహనం చెందించినప్పుడు నత్రజని, నీరు ఏర్పడును. ఇది ఉష్ణ గ్రాహాక చర్య.
- 4 NH3 + 3O2 → 2 N2 + 6 H2O (g) (ΔH°r = −1267.20 kJ/mol)
అమ్మోనియా దహన చర్యలో డై నైట్రోజన్, థెర్మోడైనమిక్ ఉత్పత్తిగా ఏర్పడును. ఏర్పడు అన్ని నైట్రోజన్ ఆక్సైడులు అస్థిరమైనవి.సరియైన ఉత్పేరకం సమక్షంలో,గతిశక్తి ఉత్పత్తిగా అమ్మోనియా నుండి నైట్రోజన్ ఆక్సైడ్ లను ఉత్పత్తి చెయ్యవచ్చును. పారిశ్రామికంగా నైట్రిక్ ఆసిడ్ ను ఈ పద్ధతిలో ఉత్పత్తి చెయ్యుదురు.మొదటి దశ చర్యలో అమ్మోనియా నుండి NO ఉత్పత్తి అగును
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
ఆ తరువాత క్రమంలోని చర్య ఫలితంగా NO2ఏర్పడును.
- 2 NO + O2 → 2 NO2
అమ్మోనియా –గాలి మిశ్రమం యొక్క ఇగ్నిషన్ ఉష్ణోగ్రత కన్న దహనజ్వాల ఉష్ణోగ్రత తక్కువ కావున, సరియైన ఉత్పేరకం లేనిచో అమ్మోనియా గాలితో దహనచర్య జరపదు. అమ్మోనియా గాలితో కలిసి దహనం చెందు నిష్పత్తి 16-25%.
అమ్మోనియా తో ఏర్పడు ఇతర సంయోగ పదార్థాలు
[మార్చు]సేంద్రియ రసాయన శాస్త్రంలో ప్రత్యామ్నాయ చర్యలలో (substitution reactions)అమ్మోనియా న్యూక్లియోపిల్ గా వర్తిస్తుంది. ఆల్కైడ్ హలినాయిడ్స్ (alkyl halides)తోఅమ్మోనియా చర్య వలన అమైన్స్ ఏర్పడును. వ్యాపార స్థాయిలో మిథైల్అమైన్ను, క్లోరోమిథేన్తో అమ్మోనియాను రసాయనిక చర్య జరిపించి ఉత్పత్తి చెయ్యుదురు. కార్బోలిక్ ఆమ్ల ఉత్పత్తులతో అమ్మోనియా చర్య వలన అమైడ్స్ ఏర్పడును. ఎస్టర్లు,అన్ హైడ్రైడ్లు కూడా అమ్మోనియాతో చర్య జరపడం వలన అమైడ్ లు ఉత్పత్తి అగును. 150 -200 °C ఉష్ణోగ్రతలో కార్బోలిక్ అమ్లంయొక్క అమ్మోనియం లవణాలను నిర్జలికరణ (dehydrated ) కావించి అమైడ్ లను ఉత్పత్తి చెయ్యవచ్చును.
అమ్మోనియాలోని హైడ్రోజన్ పరమాణువును తొలగించి, దాని స్థానంలో లోహా పరమాణువులు బంధం ఏర్పరచు కొనును. మాగ్నిషియాన్ని అమ్మోనియాతో మండించి నప్పుడు మాగ్నిషియం నైట్రైడ్ (Mg3N2) ఏర్పడును. వేడి చెయ్యబడిన సోడియం, పొటాషియంల మీదుగా అమ్మోనియా వాయువును ప్రసరింప చేసిన సోడామైడ్ (NaNH2),పోటా సామైడ్ (KNH2) ఏర్పడును. IUPAC సిపారసు ప్రకారం అమ్మోనియా పదానికి ప్రత్నామ్యాయంగా అజాన్ (azane)పదాన్ని ఉపయోగించవచ్చును.కనుక క్లోరోఅమైన్ ను ప్రత్నామ్యాయంగాక్లోరో అజాన్ అని పిలువవచ్చు,అయితే క్లోరో అమ్మోనియా అనిమాత్రం కాదు.
సాధారణంగా అమ్మోనియం హైడ్రైడ్గా తెలిసిన లేదా λ5-అమైన్ గాపిలువబడు ఘన స్పటిక పెంటా వేలంట్ అమ్మోనియా (పంచబంధ) అధిక వత్తిడి వద్ద మాత్రమే స్థిర మైనది. సాధారణ పరిస్థితు లలో ఇది వియోగం చెంది ట్రై వేలంట్ (త్రిబంధ) అమ్మోనియాగా ఏర్పడును.
అమ్మోనియాలో ఇతర లవణాల ద్రావణీయత
[మార్చు]నీటితో సమానం కానప్పటికీ అమ్మోనియా ద్రావణం ఒక అయనీకరణ ద్రావణి (ionising solvent), నైట్రేట్ లు, నైట్రైల్సు, సైనైడులు,, థియోసైనైట్ వంటి అయోనిక్ సమ్మేళనాలు అమ్మోనియా ద్రావణంలో కరుగును. చాలా అమ్మోనియం లవణాలు అమ్మోనియాలో కరుగును,, ఇవి అమ్మోనియా ద్రావణంలో కరిగినపుడు ఆమ్లాల వలె ప్రవర్తించును. అమ్మోనియా ద్రావణంలో హేలినైడు ల ద్రావణీయత ఫ్లోరైడ్ నుండి మొదలుకుని అయోడైడ్ వరకు క్రమంగా పెరుగును. అమ్మోనియం నైట్రేట్ సంతృప్త ద్రావణం, 0.83 మోల్ ద్రావితాన్ని (solute)ను ఒకమోల్ అమ్మోనియా ద్రావణంలో కలిగిఉండును,, బాష్పిభవన వత్తిడి 1 బార్ కన్న తక్కువగా ఉండును (25°Cవద్ద)
అమ్మోనియా ద్రావణంలో కరుగు వివరాలు కొన్ని లవణాలద్రావణీయత వివరాలు
| లవణాలు | 100 గ్రాముల అమ్మోనియా ద్రావణంలో గ్రాముల కరిగిన లవణం |
| అమ్మోనియం అసిటేట్ | 253.2 |
| అమ్మోనియం నైట్రేట్ | 389.6 |
| లిథియం నైట్రేట్ | 243.7 |
| సోడియం నైట్రేట్ | 97.6 |
| పొటాషియం నైట్రేట్ | 10.4 |
| సోడియం ఫ్లోరైడ్ | 0.35 |
| సోడియం క్లోరైడ్ | 157.0 |
| సోడియం బ్రోమైడ్ | 138.0 |
| సోడియం అయోడైడ్ | 161.9 |
| సోడియం థయోసైయనేట్ | 205.5 |
అమ్మోనియా యొక్క లోహాల ద్రావణాలు
[మార్చు]ద్రవ అమ్మోనియాలో క్షారలోహాలు మఱియు ఎలక్ట్రోధనాత్మకత కలిగిన మాగ్నీషియం,కాల్షియం,స్ట్రాన్షియం,బేరియం,యురోపియం,, ఎట్టేర్బియం వంటి మూలకాలను తనలో కరగించు కొనును.తక్కవ గాఢత (0.06 మోల్ /లీ )లో ముదురు నీల వర్ణపు ద్రావణాలను ఏర్పరచును. ఈ తక్కువ గాఢత ద్రావనాలు లోహ కేటయానులను, అమ్మోనియా అణువు పంజరంచే ఆవృతమైన స్వేచ్ఛ ఎలక్ట్రానులను కలిగి ఉండును. ఇటువంటి ద్రవణాలు బలమైన ఆక్సీకరణ కారకాలుగా ఎంతో ఉపయోగకరం.ఎక్కువ గాఢత ద్రావణాలు ప్రవర్తనలోను, విద్యుత్తు వాహక తత్వంలో లోహాతత్త్వం ప్రదర్శించును. తక్కువ ఉష్ణోగ్రత వద్ద ఈ రెండురకాల ద్రావణాలు ఒక దానితో ఒకటి కరగకకుండా,కల్సిఉంటాయి.
ఉత్పత్తి వివరాలు
[మార్చు]2006 లో విశ్వవ్యాప్త అమ్మోనియా ఉత్పత్తి 146.5 మిలియను టన్నులు కాగా,20 12 లో 198 మిలియను టన్నుల అమ్మోనియాను ఉత్పత్తి చేసారు అనగా 2006 కన్న 35%ఉత్పత్తిలో వృద్ధి జరిగింది.అణువుకు ద్విధ్రువచలన గుణం కల్గించి,వలన లవణాలు ఏర్పడును.
ఉపయోగాలు
[మార్చు]అమ్మోనియాను రసాయన ఎరువుగా,ద్రావణిగా, నత్రజని కలిగిన సంయోగ పదార్థాల ఉత్పత్తికి పుర్వగామి (precursor)గా,ఇంధనంగా,ప్రయోగశాలలో రసాయనకారకంగా
రసాయన ఎరువు
[మార్చు]ఉత్పత్తి అగుచున్న అమ్మోనియాలో 83% (2004సం.లెక్కల ప్రకారంగా)ను రసాయనిక ఎరువుల తయారిలో ఉపయోగిస్తున్నారు. ముఖ్యంగా మొక్కజొన్న, గోధుమ పంటల సాగుభూములలో అమ్మోనియాను వాడినప్పుడు దిగుబడి అధికంగా వచ్చును. అమెరికాలో వ్యవసాయపరంగా ఉపయోగించు నత్రజనిలో 30 % న్ని నిర్జల అమ్మోనియా రూపంలో ఉపయోగిస్తున్నారు.ప్రపంచ వ్యాప్తంగా 110 మిలయన్ టన్నుల అమ్మోనియాను ఎరువుగా వాడుచున్నారు.
నత్రజని సమ్మేళనాల ఉత్పత్తికి పూర్వగామి
[మార్చు]అమ్మోనియా ప్రత్యక్షంగా, పరోక్షంగా పలు నత్రజని కలిగిన సంయోగ పదార్థాల ఉత్పత్తికి పుర్వగామి (precursor)పాత్రను పోషిస్తున్నది.నిజానికి కృత్తిమంగా ఉత్పత్తి చెయ్యబడుచున్న నత్రజని సంయోగ పదార్థాలన్నీ అమ్మోనియా నుండే ఉత్పత్తి చెయ్యబడు చున్నవి. అటువంటి నత్రజని యుత సంయోగ పదార్థాలలో నైట్రిక్ ఆమ్లం ఒకటి. ఈ ఆమ్లాన్ని ఆస్త్వాల్ద్ (Ostwald)పద్ధతిలో అమ్మోనియాను గాలితో ఆక్సీకరణ చెందించి తయారు చేయుదురు. 700-850 °C,9 అట్మాసిఫియరు పీడనం వద్ద, ప్లాటినం ఉత్పేరకం సమక్షములో గాలితో అమ్మోనియాను ఆక్సీకరణ కావించడం వలన నత్రికామ్లం ఏర్పడును. ఈ చర్యలో నైట్రిక్ ఆక్సైడ్ మధ్యంతర ఉత్పత్తి ( intermediate)గా ఏర్పడును.
- NH3 + 2 O2 → HNO3 + H2O
నత్రికామ్లంనుండి రసాయనిక ఎరువులు,ప్రేలుడు పదార్థాలు, ఆర్గానో నైట్రోజన్ సమ్మేళనాలను తయారు చేయుదురు.
అమ్మోనియానుండి ఉత్పత్తిఅగు ఇతర సమ్మేళనాలు
[మార్చు]అమ్మోనియానుండి ఈ దిగువ పేర్కొన్న సమ్మేళనాలను కూడా ఉత్పత్తి చెయ్యుదురు.
- హైడ్రాజైన్ను ఒలిన్ రాచిక్ ప్రాసెసింగ్ లేదా పెరాక్సైడ్ విధానంలో ఉత్పత్తి చేయుదురు.
- హైడ్రోజన్ సైనైడ్ను BMAప్రాసెస్ లేదా అండ్రుసో విధానంలో ఉత్పత్తి చేయుదురు.
- హైడ్రాక్సీలమైన్, అమ్మోనియం కార్బోనేట్ను రాచిక్ ప్రాసెసింగ్ విధానంలో ఉత్పత్తి చేయుదురు.
- ఫెనోల్* (phenol)ను రాచిక్ హుకర్ ప్రాసెసింగ్ విధానంలో ఉత్పత్తి చేయుదురు.
- యురియాను బోష్ –మేఇసేర్ యూరియా ప్రాసెస్, వోహ్లెర్ సింథసిస్ పద్ధతిలో ఉత్పత్తి చేయుదురు.
- అమినో ఆసిడ్ను స్ట్రేకెర్అమినో ఆసిడ్ సింథసిస్ విధానంలో ఉత్పత్తి చెయ్యుదురు.
- అక్రిలోనైట్రైల్ను సొహిఒ ప్రాసెస్ విధానంలో ఉత్పత్తి చెయ్యుదురు.
కిణ్వన ప్రక్రియ/పులియబెట్టడం
[మార్చు]పదార్థాలను పులియపెట్టే పరిశ్రమలలో16%- 25% అమ్మోనియా ద్రావణాన్ని కిణ్వనకారకంగా ఉపయోగిస్తారు. అమ్మోనియా16%- 25% ద్రావణం,పులియబెట్టు సమయంలో, మైక్రో ఆర్గానిజానికి అవసరమైన నత్రజని అందించు వనరుగా,,అవసరమైన pH ని ఏర్పరచుటకు సహకారిగా పనిచేయును.
ఆహార ఉత్పత్తుల సూక్ష్మజీవ నిరోధక కారకం
[మార్చు]1875 నాటికే అమ్మోనియా బలమైన అంటి సెప్టిక్/క్రిమినాశకం అని గుర్తించారు..బీఫ్ టిని ప్రేసర్వ్/ సంరక్షణ చేయుటకు ఒక లీటరుకు 1.4 గ్రాముల అమ్మోనియా సరిపోతుంది.ఒక పరిశోధనలో అమ్మోనియా మూడు రకాల జంతు ఆహారంలోని 99 .9 % జూ నోటిక్ బాక్టీరియాను నాశనంచేసినట్లు తెలియ వచ్చింది.నిర్జల అమ్మోనియా బీఫ్ లోని సూక్ష్మజీవులను తొలగిస్తుంది.
శీతలీకరణి
[మార్చు]శీతలీకరణ పరికారాలలో/యంత్రాలలో శీతలీకరణి (refrigerant)గా మొదట అమ్మోనియా వాయువునే ఉపయోగించేవారు. తరువాతి కాలంలో క్లోరో కార్బన్ (Freons)వాయువులను అమ్మోనియా వాయువుకు ప్రత్నామ్యాయంగా వాడటం మొదలైనది. పారిశ్రామిక శీతలీకరణలో ఎక్కువ శక్తి సామర్ధ్యం,తక్కువ ఖరీదు కారణంగాఅమ్మోనియాను అధికంగా ఉపయోగిస్తారు.అయితే అమ్మోనియాకున్న విషగుణం కారణంగా గృహ శితలీకరణపరికరాలలోను,తక్కువ స్థాయి శితలికరణ యంత్రాలలో అమ్మోనియా వాడకం తక్కువ.
వాయు ప్రక్షాళిని/ మార్జకము(scrubber)
[మార్చు]శిలాజ ఇంధనాలను దహించునప్పుడు వెలువడు సల్ఫర్ డై ఆక్సైడ్ (SO2)ను అమ్మోనియా వాయువుతో ప్రక్షాళన/ మార్జకము చెయ్యడం వలన సల్ఫర్ డై ఆక్సైడ్ అమ్మోనియాతో చర్య వలన అమ్మోనియం సల్ఫేట్ గా పరివర్తింప బడును.ఈ విధంగా ఏర్పడిన అమ్మోనియం సల్ఫేట్ను రసాయన ఎరువుగా ఉపయోగిస్తారు. డీసెల్ ఇంజను లనుండి వెలువడు నైట్రోజన్ ఆక్సైడ్ కలుషితము లను అమ్మోనియా తటస్థి కరిస్తుంది.
ఇంధనంగా వాడకం
[మార్చు]
రెండవ ప్రపంచ యుద్ధం కాలంలో జర్మనీలోని బెల్జియంలో బస్సులను నడుపుటకు ఇంధనంగా వాడినారు. 1900 ముందు దహన యంత్రాలలో, సోలార్ అప్లికేసనులలో కూడా ఉపయోగించిన దాఖాలాలు ఉన్నాయి.ద్రవ అమ్మోనియాను ఇంధనంగా రియాక్షన్ మోటార్సు XLR99 రాకెట్ ఇంజెనులో ప్రయోగించారు. ఈ మోటారు ఇంజనును x-15 హైపర్ సోనిక్ రిసెర్చ్ విమానములో అమర్చారు. అంతర్గత దహన యంత్రాలలో (I.Cengine)లలో శిలాజ ఇంధనానికి ప్రత్నామ్యాయంగా అమ్మోనియాను సిపారసు చెయ్యడం జరిగింది.
అమ్మోనియా యొక్క కెలరిఫిక్ విలువ 22.5 మెగా జౌల్స్ /కిలో (9690BTU/పౌండ్),అనగా డీసెల్ యొక్క కెలరిఫిక్ విలువలో దాదాపు సగం. అయితే అమ్మోనియాను ప్రస్తుతమున్న ఆక్టోసైకిల్ ఇంజనులలో సమర్ధ వంతంగా ఉపయోగించ లేము. ఇంజను యొక్క కార్బోరేటర్, ఇంజెక్టరుల డిజైనులలో మార్పులు అవసరం .
జౌళి పరిశ్రమలో
[మార్చు]ద్రవ అమ్మోనియాను ప్రత్తి వస్తువులను ట్రేట్ మెంట్ చెయ్యుటకు ఉపయోగిస్తారు.ప్రత్యేకంగా ఉన్నిని ముందస్తు ఉతుకు (prewashing)లో ఉపయోగిస్తారు.
గృహాలలో అమ్మోనియా వినియోగం
[మార్చు]5-15% (బరువు ప్రకారం)అమ్మోనియా ద్రావణాన్నిఇళ్ళలో క్లినింగ్ లిక్విడ్గా, ప్రత్యేకంగా గాజు వస్తువులను క్లినింగు చెయ్యుటకు ఉపయోగిస్తారు.ఈ వాయువు ఆవిరిలు లేదా ద్రావణం కళ్ళకు సోకిన కళ్ళు మండును.మ్యూకస్ పొరలను (శ్వాసకోశ,జీర్ణాశయం పొరలు)సోకినను ఇరిటేసను కలుగును. ఇళ్ళలో వాడునప్పుడు అమ్మోనియా ద్రావణం క్లోరిన్ కలిగిన వస్తువులతో కలువరాదు, కలిసిన విష వాయువులను వెలువరించును.
ప్రయోగ శాలలో అమ్మోనియా వినియోగం
[మార్చు]అమ్మోనియా ద్రావణం యొక్క ప్రమాద స్థాయి,దానియొక్క గాఢత మీద ఆధారపడి ఉంది. 5-15% (బరువు ప్రకార౦)అమ్మోనియా కలిగిన ద్రావణంలను సజల అమ్మోనియా ద్రావణం అనియు, 25%కి మించి అమ్మోనియా కలిగిన అమ్మోనియా ద్రావణంలను గాఢ ద్రావణం అనియు వ్యవరిస్తారు.25% (బరువు,ఆధారంగా)అమ్మోనియా కలిగిన ద్రావణం సాంద్రత 0.907గ్రాములు/సెం.మీ3.ఇంతకన్నతక్కువ సాంద్రత ఉన్న అమ్మోనియా ద్రావాణాలు ఎక్కువ గాఢత కలిగి ఉండును. యురోపియన్ యూనియన్ వర్గీకరణ ప్రకారం వివిధ గాఢత కలిగిన అమ్మోనియా ద్రావణంల పట్టిక
గాఢత
భారం/భారంమోలారిటి గాఢ త
భారం/ఘ.ప.వర్గీకరణ R-phases 5-10% 2.87-5.6 2 మోల్/ లీ 48 .9-95.7 గ్రాములు/లీ ఇరిటెంట్ (Xi) R36/37/38 10-25 % 5.6 2-13.29మోల్ /లీ 95.7-226.3 గ్రాములు/లీ కొర్రెసివ్ (C) R34 25%ఎక్కువ >13.29మోల్ /లీ >226.3 గ్రాములు/లీ కొర్రెసివ్ (C)
పరిసరాలకు
ప్రమాదకారిR34, R50
గాఢత కలిగిన అమ్మోనియా ద్రావణంల నుండి వెలువడిన ఆవిరులు కళ్ళకు,, శ్వాస కోశవ్యవస్థకు ఇరిటేసన్ కలిగించును. ఇటువంటి గాఢత కలిగిన అమ్మోనియా ద్రావణం కలిగిన బాటిల్ల మూతను పోగగదిలో (fume hood) ఉంచి తెరువవలెను.వెచ్చని వాతావరణంలో సంతృప్త అమ్మోనియా ద్రవాణాలు (0.880 సాంద్రత), మూసి ఉంచిన బాటిల్/ పాత్రలలో వత్తిడిని పెంచును.అలాంటి వాటిని తగు జాగ్రత్తలుతీసుకోని తెరువ వలెను. 25% అమ్మోనియా ద్రావణంలో అటువంటి సమస్యలు లేవు.
అమ్మోనియం ద్రావణాన్ని హలోజన్లను కలుపరాదు, కలిపిన విషపూరితమైన, విస్పొటన గుణమున్న ఉత్పత్తులు ఏర్పడును.వెండి,పాదరసం,లేదా అయోడైడ్ లవణాలతో అమ్మోనియా ద్రావణం యొక్క దీర్ఘకాలిక సంపర్కం విస్పోటన ఉత్పత్తుల ఉత్పత్తికి దారితియ్య వచ్చును.ఇటువంటివి ద్రావాణ మిశ్రమాలు గుణాత్మక అకర్బన విశ్లేషణ వలన జరుగు సంభవం ఉంది.
విషప్రభావం
[మార్చు]మానవుల,క్షీరదాల రక్త ప్రవాహ వ్యవస్థలోఅమ్మోనియా విష ప్రభావాన్ని నిలువరించే మెకానిజం నెలకొని ఉంది.దేహంలో ప్రవేశించిన అమ్మోనియా carbamoyl phosphate synthetase అను ఎంజైమ్ వలనcarbamoyl phosphate గా పరివర్తింపబడి యూరియా చక్రీయవ్యవస్థలోలో చేరి,అమినో ఆసిడ్గా ఏర్పడును.లేదా మూత్రం ద్వారా విసర్జింప బడును.చేపలు,, ఉభయ చరాలకు ఇటువంటి అమ్మోనియా విష ప్రభావాన్ని నిలువరించే మెకానిజం లేదు.అవి శరీరం నుండి అమ్మోనియాను నేరుగా విసర్జించును.అందుచేత నీటిలో తక్కువ ప్రమాణంలో అమ్మోనియా ఉన్నను ఈ జీవులకు ప్రాణాంతకం .
ముందస్తు రక్షణ జాగ్రత్తలు
[మార్చు]అమెరికా యొక్క Occupational Safety and Health Administration (OSHA)అమ్మోనియాపరంగా కొన్ని రక్షణ జాగ్రత్తలను నిర్దేశించింది.వాతావరణంలో 35 ppm/ఘనపరిమాణం ఉన్నఅమ్మోనియా వాయువు ప్రభావానికి 15 నిమిషాల లోపుగురైన ప్రమాదం లేదు. 25 ppm అమ్మోనియా ఉన్న వాతావరణ పరిస్థితిలో 8 గంటలవరకు పర్వాలేదు.
భద్రముగా నిల్వ ఉంచుట
[మార్చు]ప్రొపేన్ వాయువువలె నిర్జల అమ్మోనియా వాయువు, వాతావరణ పీడనం వద్ద (1.013 బార్)బాష్పీభవించును. అందువలన దృఢమైన వత్తిడిని తట్టుకో గలిగిన పాత్రలో 250psi (1.7 Mpa)వద్ద నిల్వ ఉంచెదరు. అమ్మోనియం సమ్మేళనాలను ఎటువంటి పరిస్థితి లోను అనవసరంగా క్షారాలతో కలువనివ్వరాదు. అలా కలవడం వలన ప్రమాద స్థాయిలో, ఒకేసారి పెద్ద మొత్తంలో అమ్మోనియా వాయువు వెలువడుఅవకాశం ఉంది.
ఇవి కూడా చూడండి
[మార్చు]మూలాలు
[మార్చు]- ↑ http://www.engineeringtoolbox.com/gas-density-d_158.html
- ↑ Yost, Don M. (2007). "Ammonia and Liquid Ammonia Solutions". Systematic Inorganic Chemistry. READ BOOKS. p. 132. ISBN 1-4067-7302-6.
- ↑ Blum, Alexander (1975). "On crystalline character of transparent solid ammonia". Radiation Effects and Defects in Solids. 24 (4): 277. doi:10.1080/00337577508240819.
- ↑ Budavari, Susan, ed. (1996). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th ed.). Merck. ISBN 0-911910-12-3.
- ↑ Perrin, D. D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed., Pergamon Press: Oxford, 1982.
- ↑ 6.0 6.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 0-618-94690-X.
- ↑ 7.0 7.1 7.2 మూస:Sigma-Aldrich
- ↑ "Ammonia". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ NIOSH Pocket Guide to Chemical Hazards. "#0028". National Institute for Occupational Safety and Health (NIOSH).