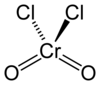
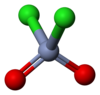
క్రోమైల్ క్లోరైడ్
| |||

| |||
| పేర్లు | |||
|---|---|---|---|
| Preferred IUPAC name
క్రోమియం(VI) డై క్లోరైడ్ డైఆక్సైడ్ | |||
| Systematic IUPAC name
డై క్లోరో డైఆక్సో క్రోమియం | |||
| ఇతర పేర్లు
క్రోమిక్ ఆసిడ్ క్లోరైడ్
క్రోమియం ఆక్సీక్లోరైడ్Etard Reagent క్లోరోక్రోమిక్ అంహైడ్రైడ్ క్రోమిక్ ఆక్సీక్లోరైడ్ క్రోమియం క్లోరైడ్ ఆక్సైడ్ క్రోమియం డయాక్సైడ్ డై క్లోరైడ్ క్రోమియం డయాక్సీక్లోరైడ్ క్రోమియం ఆక్సీక్లోరైడ్ | |||
| గుర్తింపు విషయాలు | |||
| సి.ఎ.ఎస్. సంఖ్య | [14977-61-8] | ||
| పబ్ కెమ్ | 22150757 | ||
| యూరోపియన్ కమిషన్ సంఖ్య | 239-056-8 | ||
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:33038 | ||
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | GB5775000 | ||
| SMILES | Cl[Cr](Cl)(=O)=O | ||
| ధర్మములు | |||
| CrO2Cl2 | |||
| మోలార్ ద్రవ్యరాశి | 154.9008 g/mol | ||
| స్వరూపం | deep red fuming liquid | ||
| వాసన | musty, burning, acrid[1] | ||
| సాంద్రత | 1.911 g/mL, liquid | ||
| ద్రవీభవన స్థానం | -96.5 °C | ||
| బాష్పీభవన స్థానం | 117 °C | ||
| Reacts[1] | |||
| బాష్ప పీడనం | 20 mmHg (20 °C)[1] | ||
| ప్రమాదాలు | |||
| ప్రధానమైన ప్రమాదాలు | carcinogen, reacts violently with water[1] | ||
| R-పదబంధాలు | మూస:R49 మూస:R46 R8 R35 మూస:R43 R50/53 | ||
| S-పదబంధాలు | S53 S45 S60 S61 | ||
| జ్వలన స్థానం | {{{value}}} | ||
| US health exposure limits (NIOSH): | |||
PEL (Permissible)
|
none[1] | ||
REL (Recommended)
|
Ca TWA 0.001 mg Cr(VI)/m3[1] | ||
IDLH (Immediate danger)
|
N.D.[1] | ||
| సంబంధిత సమ్మేళనాలు | |||
సంబంధిత సమ్మేళనాలు
|
SO2Cl2; VOCl3; MoO2Cl2; WO2Cl2; CrO2F2 | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||
క్రోమైల్ క్లోరైడ్ ఒక రసాయనిక సంయోగ పదార్థం లేదా సమ్మేళన పదార్ధం. క్రోమైల్ క్లోరైడ్ యొక్క రసాయనిక ఫార్ములా CrO2Cl2 . అనగా ఈ రసాయన సమ్మేళన పదార్ధం క్రోమియం, క్లోరిన్, ఆక్సిజన్ మూలక పరమాణువుల సంయోగం వలన ఏర్పడినది. సాధారణ వాతావరణ వత్తిడి, గది ఉష్ణోగ్రత ల వద్ద క్రోమైల్ క్లోరైడ్ అపారదర్శిక రక్తం వంటి ఘాడమైన ఎరుపు రంగులో ఉన్న ద్రవం. సల్ఫ్యురిల్ క్లోరైడ్ ( SO2Cl2) సంయోగ పదార్ధం వలె చతుర్భుజ అణుసౌష్టం క్రోమైల్ క్లోరైడ్ కల్గివున్నది. సల్ఫ్యురైల్ క్లోరైడ్, క్రోమైల్ క్లోరైడ్ ఒకేరకమైన అణునిర్మాణాన్ని కల్గివున్నను, వాటి ఆక్సీకరణ ధర్మాలు, భౌతిక ధర్మాలు వేరువేరు.
తయారుచేయుట
[మార్చు]పొటాషియం క్రోమేట్ లేదా పొటాషియం డైక్రోమేట్ ను సోడియం క్లోరైడ్తో మిశ్రమం కావించి ఈ మిశ్రమాన్ని గాఢ సల్ఫ్యూరిక్ ఆమ్లంతో చర్య నొందించఛి, పిమ్మట నెమ్మదిగా స్వేదన క్రియ ద్వారా వేరు కావించి ఉత్పత్తి చేయుదురు.
- K2Cr2O7 + 4NaCl + 6H2SO4 → 2CrO2Cl2 + 2KHSO4 + 4NaHSO4 +3H2O
భౌతిక ధర్మాలు
[మార్చు]క్రోమైల్ క్లోరైడ్ యొక్క అణుబారం 154.901గ్రాములు/మోల్[2] ముదురు రక్తం వంటి ఎరుపు వర్ణాన్ని కల్గియున్న ఆపార్శక ద్రావణం. ద్రవీభవన స్థానం -96.5 °C. బాష్పీభవన స్థానం 117 °C.[3] క్రోమైల్ క్లోరైడ్ ద్రావణం యొక్క సాంద్రత 1.911 గ్రాములు/మిలీ[4]
రసాయన ధర్మాలు
[మార్చు]క్రోమైల్ క్లోరైడ్అమితమైన ఎలక్ట్రాన్ ఆకర్షక/ఎలక్ట్రో ఫిలిక్ (electrophilic) గుణం కల్గిన సంయోగ పదార్ధం.అంతియే కాదు తీవ్రమైన ఆక్సీకరణ కారకం కూడా.అందువలన దీనిని అస్ఫాటిక (amorphous) సల్ఫర్లో ముంచిన దహనం చెందును.అంతియే కాదు టోలిన్/toluene ను బెంజాల్ డిహైడ్ (benzaldehyde) గా ఆక్సీకరించును.
క్రోమైల్ క్లోరైడ్యొక్క అమితమైన ఎలక్ట్రో ఫిలిక్ (electrophilic) గుణం వలన హైడ్రోక్లోరిక్ ఆమ్లాన్ని జలవిశ్లేషణ ప్రక్రియ ద్వారా క్రోమిక్ ఆమ్లంగా పరివర్తించును.
- CrO2Cl2 + 2H2O → H2CrO4 + 2HCl
క్రోమైల్ క్లోరైడ్ నీటితో కూడా చురుకైన చర్యాశీలత కల్గిఉన్నది. అందువలననే తేమ గల్లిన గాలిలో పొగలను క్రోమైల్ క్లోరైడ్ఏర్పరచును. పలు సెంద్రియ, అసేంద్రియ రసాయన పదార్థాలతో సజలరహితంగానే రసాయనిక చర్యలు జరుపును.హైడ్రోజన్ సల్ఫైడ్ లేదా ఫాస్పైన్ తో సంపర్కం వలన మందును.అంతేకాదు ఫాస్పరస్ ట్రై బ్రోమైడ్, అసిటోన్, ఇథనోల్,, టర్పైంటెన్ లతో కలవడం వలన మండును.తేమ కల్గిన ఫాస్పరస్ తో లేదా ఫాస్పరస్ ట్రైక్లోరైడ్ తో కలవడం వలన విస్పోటక చర్యలు చోటు చేసుకొనును[Bretherick, 1979, p. 822-823].[5]
పదార్థాలలో క్లోరైడ్ ఉనికి కై క్రోమైల్ క్లోరైడ్ నిర్దార పరీక్ష
[మార్చు]ఏదైనా పదార్థంలో క్లోరైడ్ ఉనికి నిర్దారనకై ఆ పదార్థాన్ని పొటాషియం డై క్రోమేట్, ఘాడ సల్ఫ్యూరిక్ అమ్లంతో చర్య కావించేదరు.అందులో క్లోరైడ్ ఉన్నచో, చర్య ఫలితంగా క్రోమైల్ క్లోరైడ్ఏ ర్పడి ఎర్రని పొగలు/ధూమం వెలువడును.అందులో క్లోరైడ్ లేనిచో ఎర్రని రసాయన ధూమం వెలువడదు.ఫ్లోరైడ్, బ్రోమైడ్, అయోడైడ్, సైనైడ్ వంటి తుల్యమైన సమ్మేళనాలు ఏర్పడవు.అందుచేత క్లోరైడును గుర్తించుటకు ఈ నిర్దార పరీక్ష క్లోరైడ్ ఉనికిని గుర్తించుటకు సరియైన పరీక్షావిధానం.
క్రోమైల్ క్లోరైడ్- ఆల్కిన్సు ను ఆక్సీకరణ కారకం
[మార్చు]ఉపయోగించిన ద్రావణి/సాల్వెంట్ ను అనుసరించి క్రోమైల్ క్లోరైడ్ రసాయన పదార్ధం ఆక్సీకరణ ద్వారా ఆల్కినులను ఆల్డిహైడ్ లు మార్చును.క్రోమియం క్లోరైడ్ తో ఆక్సీకరణ చర్య వలన ఇంటర్నల్ ఆల్కినులు ఆల్ఫా-క్లోరో కిటోనులు లేదా సంబంధిత రసాయన సంయోగ పదార్థాలను ఏర్పరచును.ఎటార్డ్ చర్య (Étard reaction) ద్వారా బెమ్జిలిక్ మిథైల్ సమూహం/గ్రూఫ్ తో చర్య వలన ఆల్డిహైడులను ఏర్పరచును. అంతియే కాక ఏదైనా పదార్థాలలో నైట్రేట్ అయానులు లేక పోవటాన్ని కనుగొను పరీక్షలో క్రోమియం క్లోరైడ్ రసాయన సంయోగ పదార్థాన్ని వాడతారు.
తగిన/అనుకూలమైన సాల్వెంటులు
[మార్చు]క్రోమియం అత్యంత శక్తి వంతమైన రసాయన కారకం కావడం వలన దీనితో ఉపయోగించు సాల్వెంట్ లను జాగ్రత్తగా ఎంపిక చెయ్యాలి.ఇది నీటితో అత్యంత రసాయన చర్యాశీలత కల్గిఉన్నందున, ఇది అల్కహాలులతో సంపర్కం వలన వాటిని వియోగం కావించును.వెనడియం అక్సిట్రై క్లోరైడ్ (VOCl3, టైటానియంటెట్రా క్లోరైడ్ (TiCl4),, సల్ఫ్యురిల్ క్లోరైడ్ (SO2Cl2). వంటి క్లోరైడ్ వంటి ఎలక్ట్రో ఫిలిక్సంయోగ పదార్థాలు ఇటువంటి లక్షణాన్నే కల్గి ఉన్నాయి.అందువలన క్రోమైల్ క్లోరైడ్ వంటి వాటితో క్లోరో కార్బను సాల్వెంట్ లు ఉత్తమైనవి.ముఖ్యంగా డై క్లోరో మిథేన్ సాల్వెంట్.
రక్షణ భద్రత పరంగా
[మార్చు]క్రోమైల్ క్లోరైడ్ నీటితో చర్య వలన హైడ్రో క్లోరిక్ ఆమ్లం, హెక్సా వాలెంట్ క్రోమియం (CrVI) విడుదల చేయును.హైడ్రోక్లోరిక్ఆమ్లం ప్రాణ హానికరం. క్రోమైల్ క్లోరైడ్ ఆవిరుల ప్రభావానికి మనసులు గురైన శ్వాస కోశ వ్యవస్థలో తాపం/మంట పుడుతుంది.కళ్ళకు ఆవిరులు తాకినా కళ్ళు విపరితంగామండును, నీళ్ళు కారును. అలాగే చర్మాన్ని తాకినకూడాబొబ్బలు, పుండ్లు ఏర్పడును. తరచుగా చర్మం క్రోమెయిల్ క్లోరైడ్ తో సంపర్కం వలన వ్రణాలు, పుళ్ళు ఏర్పడును.కడుపులోకి వెళ్ళిన అంతర్గత అవయాలకు నష్టం వాటిల్లును.
దీర్ఘకాలిక ఆరోగ్య ప్రభావం:క్రోమియం VI రసాయనం మానవ దేహ వ్యవస్థలో క్రోమోజోముల అస్వాభావికత కల్గించును, ఆకారణంగా దాని ఆవిరులను పీల్చడం వలన క్యాన్సరు వచ్చే ప్రమాదం పొంచివున్నది[6]. అందు వలన క్రోమైల్ క్లోరైడ్ ను వాడునపుడు ముందస్తుగా తగిన జాగ్రత్తలు తీసుకోవాలి. ఇది రబ్బరు పలు ప్లాస్టికు వస్తువులతో తీవ్రంగా చర్య జరుపును కావున నిల్వ ఉంచు సమయంలో అన్ని జాగ్రత్తలు తీసుకోవాలి.
మూలాలు/ఆధారాలు
[మార్చు]- ↑ ఇక్కడికి దుముకు: 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 NIOSH Pocket Guide to Chemical Hazards. "#0142". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Chromyl chloride". webbook.nist.gov. Archived from the original on 2017-03-11. Retrieved 2017-03-11.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ↑ "CHROMYL CHLORIDE". pubchem.ncbi.nlm.nih.gov. Archived from the original on 2017-03-11. Retrieved 2017-03-11.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ↑ "Chromyl Chloride". americanelements.com. Archived from the original on 2017-03-11. Retrieved 2017-03-11.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ↑ "Chromyl chloride". chemicalbook.com. Archived from the original on 2017-03-11. Retrieved 2017-03-11.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ↑ "CHROMYL CHLORIDE". toxnet.nlm.nih.gov. Retrieved 2017-03-11.
[[వర్గం:క్రోమియం సమ్మేళనాలు]]