టివోజానిబ్
| |
|---|---|
| Clinical data | |
| వాణిజ్య పేర్లు | ఫోటివ్డా |
| అమెరికన్ సొసైటీ ఆఫ్ హెల్త్ సిస్టం ఫార్మాసిస్ట్స్(AHFS)/డ్రగ్స్.కామ్ | monograph |
| MedlinePlus | a621018 |
| లైసెన్స్ సమాచారము | EMA:[[[:మూస:EMA-EPAR]] Link], US Daily Med:link |
| ప్రెగ్నన్సీ వర్గం | ? |
| చట్టపరమైన స్థితి | POM (UK) ℞-only (US) Rx-only (EU) |
| Routes | నోటిద్వారా |
| Pharmacokinetic data | |
| Protein binding | >99% |
| అర్థ జీవిత కాలం | 4.5–5.1 days |
| Excretion | 79% మలం, 12% మూత్రం |
| Identifiers | |
| CAS number | 475108-18-0 |
| ATC code | L01EK03 |
| PubChem | CID 9911830 |
| IUPHAR ligand | 6058 |
| ChemSpider | 8087481 |
| UNII | 172030934T |
| KEGG | D09683 |
| ChEBI | CHEBI:91327 |
| ChEMBL | CHEMBL1289494 |
| Synonyms | AV-951 |
| Chemical data | |
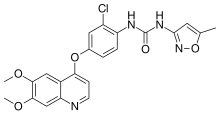
| Formula | C22H19ClN4O5 |
| |
టివోజానిబ్, అనేది ఫోటివ్డా బ్రాండ్ పేరుతో విక్రయించబడింది. ఇది మూత్రపిండ కణ క్యాన్సర్ చికిత్సకు ఉపయోగించే ఔషధం.[1] ఇతర చికిత్సలు విఫలమైన అధునాతన వ్యాధికి ప్రత్యేకంగా ఇది ఉపయోగించబడుతుంది.[1] ఇది నోటి ద్వారా తీసుకోబడుతుంది.[1]
అలసట, అధిక రక్తపోటు, విరేచనాలు, వికారం, స్వరంలో మార్పు, తక్కువ థైరాయిడ్, దగ్గు, నోటి మంట వంటి సాధారణ దుష్ప్రభావాలలు ఉన్నాయి.[1] ఇతర దుష్ప్రభావాలలో తక్కువ సోడియం, గుండె సమస్యలు, రక్తం గడ్డకట్టడం, రక్తస్రావం, పెరిగిన లిపేస్ ఉండవచ్చు.[1] గర్భధారణ సమయంలో ఉపయోగించడం శిశువుకు హాని కలిగించవచ్చు.[1] ఇది విఈజిఎఫ్ రిసెప్టర్ టైరోసిన్ కినేస్ ఇన్హిబిటర్, ఇది కొత్త రక్త నాళాలు ఏర్పడకుండా అడ్డుకుంటుంది.[2][1]
టివోజానిబ్ 2017లో ఐరోపాలో, 2021లో యునైటెడ్ స్టేట్స్లో వైద్యపరమైన ఉపయోగం కోసం ఆమోదించబడింది.[2][1] యునైటెడ్ స్టేట్స్లో 4 వారాల చికిత్సకు దాదాపు 26,000 అమెరికన్ డాలర్లు ఖర్చవుతుంది.[3]
మూలాలు
[మార్చు]- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 "Fotivda- tivozanib capsule". DailyMed. Archived from the original on 13 September 2021. Retrieved 12 September 2021.
- ↑ 2.0 2.1 "Fotivda EPAR". European Medicines Agency (EMA). Archived from the original on 13 May 2021. Retrieved 16 March 2021.
- ↑ "Tivozanib". Archived from the original on 31 October 2022. Retrieved 31 October 2022.
