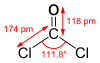కార్బొనైల్ క్లోరైడ్
| |||
| పేర్లు | |||
|---|---|---|---|
| IUPAC నామము
Carbonyl dichloride
| |||
| ఇతర పేర్లు
CG; carbon dichloride oxide; carbon oxychloride; Chloroformyl chloride; dichloroformaldehyde; dichloromethanone; dichloromethanal
| |||
| గుర్తింపు విషయాలు | |||
| సి.ఎ.ఎస్. సంఖ్య | [75-44-5] | ||
| పబ్ కెమ్ | 6371 | ||
| యూరోపియన్ కమిషన్ సంఖ్య | 200-870-3 | ||
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:29365 | ||
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | SY5600000 | ||
| SMILES | ClC(Cl)=O | ||
| |||
| ధర్మములు | |||
| COCl2 | |||
| మోలార్ ద్రవ్యరాశి | 98.92 g mol−1 | ||
| స్వరూపం | colorless gas | ||
| వాసన | suffocating, like musty hay[2] | ||
| సాంద్రత | 4.248 g/L (15 °C, gas) 1.432 g/cm3 (0 °C, liquid) | ||
| ద్రవీభవన స్థానం | −118 °C (−180 °F; 155 K) | ||
| బాష్పీభవన స్థానం | 8.3 °C (46.9 °F; 281.4 K) | ||
| decomposes in water[3] | |||
| ద్రావణీయత | soluble in benzene, toluene, acetic acid decomposes in alcohol and acid | ||
| బాష్ప పీడనం | 1.6 atm (20°C)[2] | ||
| నిర్మాణం | |||
| Planar, trigonal | |||
ద్విధృవ చలనం
|
1.17 D | ||
| ప్రమాదాలు | |||
| ఇ.యు.వర్గీకరణ | {{{value}}} | ||
| R-పదబంధాలు | R26 R34 | ||
| S-పదబంధాలు | (S1/2) S9 S26 S36/37/39 S45 | ||
| జ్వలన స్థానం | {{{value}}} | ||
| Threshold Limit Value | 0.1 ppm | ||
| Lethal dose or concentration (LD, LC): | |||
LC50 (median concentration)
|
500 ppm (human, 1 min) 340 ppm (rat, 30 min) 438 ppm (mouse, 30 min) 243 ppm (rabbit, 30 min) 316 ppm (guinea pig, 30 min) 1022 ppm (dog, 20 min) 145 ppm (monkey, 1 min)[4] | ||
LCLo (lowest published)
|
3 ppm (human, 2.83 hr) 30 ppm (human, 17 min) 50 ppm (mammal, 5 min) 88 ppm (human, 30 min) 46 ppm (cat, 15 min) 50 ppm (human, 5 min) 2.7 ppm (mammal, 30 min)[4] | ||
| US health exposure limits (NIOSH): | |||
PEL (Permissible)
|
TWA 0.1 ppm (0.4 mg/m3)[2] | ||
REL (Recommended)
|
TWA 0.1 ppm (0.4 mg/m3) C 0.2 ppm (0.8 mg/m3) [15-minute][2] | ||
IDLH (Immediate danger)
|
2 ppm[2] | ||
| సంబంధిత సమ్మేళనాలు | |||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||

కార్బొనైల్ క్లోరైడ్ ఒక రసాయన సమ్మేళనం.ఈ సమ్మేళన వాయువు యొక్క సుప్రసిద్ధ మైన పేరు ఫాస్జీన్. ఈ సంయోగ పదార్థం యొక్క రసాయన సంకేత పదం COCl2. రెండవ ప్రపంచ యుద్ధకాలంలో ఈ వాయువు ప్రాణాలు హరించే విషరసాయన వాయువుగా పేరుగాంచింది. యుద్ధకాలంలో రసాయనఆయుధాల కారణంగా సంభవించిన 100,000 మరణాలలో 85% చావులు ఫాస్జెన్/ కార్బొనైల్ క్లోరైడ్ను ఉపయోగించిన రసాయన మారణాయుధాల వలననే జరిగినవి.
కార్బొనైల్ క్లోరైడ్ ఒక విషవాయువుగా మాత్రమే కాకుండగా అనేక ఔషధ సంబంధ ఉత్పత్తులను,, సేంద్రియ సంయోగపదార్థాలను ఉత్పత్తి చేయుటకు నిర్మాణమూలాధారం (building block).ఈ వాయువు యొక్క వాసన తాజాగా కోసిన పచ్చిక/గడ్డి లేదా (ఎండు) గడ్డి వాసనను పోలి ఉండును.ఈ కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ వాయువు కేవలం పరిశ్రమలలో మాత్రమే ఉత్పత్తి చెయ్యబడటం కాకుండా, స్వల్ప ప్రమాణంలో ప్రకృతిలో స్వాభావికంగా శీతలీకరణం విధములో వాడు ఆర్గానోక్లోరిన్ సమ్మేళనాలు దహనం చెందటం వలన కుడా ఉత్పన్నమగును.
పద ఉత్పత్తి
[మార్చు]ఫాస్జెన్ అను పదం గ్రీకు పదాలైన ఫాస్ (phos, అర్థంకాంతి), జెనెసిస్ (genesisఅనగా పుట్టుక) అను పదాలనుండి సృష్టింపబడింది.అంతియే కాని ఈ సంయోగపదార్థంలో ఫాస్పరస్ (భాస్వరం: phosphorus) లేదు.
చరిత్ర-ఆవిష్కరణ
[మార్చు]1812 సంవత్సరంలో బ్రిటీష్ రసాయన శాస్త్రవేత్త జాన్ డేవి (1790–1868) అను నతడు కార్బన్ మొనాక్సైడ్, క్లోరిన్ వాయువుల మిశ్రమాన్ని సూర్యకాంతిచే ప్రభావితం కావించి కార్బొనైల్ క్లోరైడ్ ను ఉత్పత్తి చేసెను. ఈ రసాయన ప్రక్రియ జరుగుట కై సూర్య కాంతిని ఉపయోగించటం వలన ఈ వాయువుకు ఫాస్జెన్ అను పేరు ఖాయం చేసెను, పోటో (photo) అనగా కాంతి, జేనెస్ (genes) అనగా పుట్టుక, జననం.రంగు, వర్ణ పదార్థాలను కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ఉత్పత్తి చెయ్యడంమొదలవ్వడంతో 19వ శతాబ్దం ప్రారంభంలో ఈ సమ్మెళన పదార్థం ప్రాముఖ్యత పెరిగింది.
భౌతిక లక్షణాలు
[మార్చు]కార్బొనైల్ క్లోరైడ్/ ఫాస్జెన్ రంగులేని వాయువు.ఉపిరి ఉక్కిరిబిక్కిరి చెయ్యు వాసన కల్గి ఉండును.ఈ సమ్మెళన పదార్థం యొక్క అణుభారం 98.92 గ్రాములు/మోల్. 15 °C కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ వాయువు సాంద్రత 4.248 గ్రాములు/లీటరు.0 °C వద్ద, ద్రవ కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ యొక్క సాంద్రత 1.432 గ్రాములు/సెం.మీ3.కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ యొక్క ద్రవీభవన స్థానం −118 °C (−180 °F; 155K).ఈ సంయోగపదార్థం యొక్క బాష్పీభవన స్థానం 8.3 °C (46.9 °F; 281.4K) .కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ నీటితో చర్య వలన వియోగం చెందును. బెంజీన్, టోలిన్,, అసిటిక్ ఆసిడ్లలో కరుగుతుంది.
అణు నిర్మాణం
[మార్చు]కార్బొనైల్ క్లోరైడ్ ఒక్క అణుసౌష్టవం VSEPR సిద్ధాంతంలో సూచింపబడ్డ ఏక సమక్షేత్రము/ ఏకతలీయముగా ఉంది.కార్బొనైల్ క్లోరైడ్ అణువులోని C=O బంధదూరం1.18 Å., అణువు లోని C—Cl బంధ దూరం1.74 Å.అలాగే కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ అణువులోని Cl—C—Cl ల బంధాల మధ్య కోణం111.8°. కార్బొనైల్ క్లోరైడ్ వాయువు కార్బోనిక్ ఆమ్లం నుండి ఏర్పడిన అతి సామాన్య, చిన్న ఆమ్ల క్లోరైడులలో, కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ వాయువు ఒకటి.
ఉత్పత్తి
[మార్చు]పారిశ్రామికంగా కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ ను శుద్ధమైన కార్బన్ మొనాక్సైడ్, క్లోరిన్ వాయువుల నుండి ఉత్పత్తి చెయ్యుదురు. ఈ ఉత్పత్తి ప్రక్రియలో సక్రియ కర్బనాన్ని (activated carbon) ఉత్ప్రేరకంగా ఉపయోగిస్తారు. రియాక్టరులో (రసాయనికచర్య జరుపు పరికరం/పాత్ర) సఛిద్ర/ సూక్ష్మరంధ్రాలుగల, గుట్టగా ఉన్నసక్రియకర్బనం/బొగ్గు మీదుగా శుద్ధమైన కార్బన్ మొనాక్సైడ్, క్లోరిన్ వాయువులను పంపడం వలన కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ ఉత్పత్తి అగును.
- CO + Cl2 → COCl2 (ΔHrxn = −107.6kJ/mol)
ఈ కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ ఉత్పత్తి ప్రక్రియ ఉష్ణమోచక (తాపక్షేపకవేడిని వెలిపెట్టే) చర్య, అందువలన ఏర్పడిన ఉష్ణోగ్రతను తగ్గించుటకై రియాక్టరు (reactor) ను తగిన విధంగా చల్లపరచవలెను. ఈ ప్రక్రియను 50-150 °C ఉష్ణోగ్రత మధ్య జరపాలి.ప్రక్రియ/చర్యా సమయంలో ఉష్ణోగ్రత200°C దాటిన ఉత్పత్తి అయ్యిన కార్బొనైల్ డై క్లోరైడ్/ ఫాస్జీన్ తిరిగి కార్బన్ మొనాక్సైడ్, క్లోరిన్ గా పూర్వ స్థితిపొందును.1989 సంవత్సరంలో కార్బొనైల్ క్లోరైడ్ఉత్పత్తి 2.74 మిలియను టన్నులని అంచనావేసారు.
భద్రత దృష్ట్యా కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ ను ఏ పరిశ్రమలో ఉత్పతి చెయ్యుదురో, ఆపరిశ్రమ ప్రాంగణంలోనే ఉపయోగించెదరు. కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ వాయువును నిలువవుంచుటకు, వాడుటకు అసామాన్యమైన కట్టు దిట్తమైన జాగ్రత్తలు తిసికొనెదరు.
సంప్రాప్తమ లభ్యత
[మార్చు]ఆక్సిజన్ సమక్షంలో, అల్ట్రావయొలెట్ రెడియేసన్, రాడికల్ ప్రతి చర్య కారణంగా క్లోరోఫారం నెమ్మదిగా ఫాస్జీన్ వాయువుగా మారుతుంది. ఇలాంటి పోటో డిగ్రెడేషన్ (photo degradation) ను నివారంచుటకై క్లోరోఫారాన్ని బ్రౌన్రంగు కలిగిన సీసాలలో భద్రపరచెదరు. లోహాల నుండి నూనెను తొలగించుటకు ఉపయోగించు క్లోరినేటెడ్ సంయోగ పదార్థాలు, వాహనాల బ్రేకు క్లినరులు, ఆర్క్ వెల్డింగ్ ప్రక్రియలో వెలువడు అల్ట్రా వయొలెట్ (అతినీలలోహిత) కిరణాలవలన ఫాస్జీన్ వాయువుగా పరివర్తింపబడును.
ఉపయోగాలు
[మార్చు]కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ను అధికంగా టోలిన్ డైఐసోసైనేట్ (toluene di-isocyanate), మెథిలీన్ డైఫినైల్ డైఐసోసైనేట్ (methylene diphenyl diisocyanate) వంటి ఐసోసైనేట్ సమ్మేళన పదార్థాలను ఉత్పత్తి చేయుదురు. పైన పేర్కొన్న రెండు ఐసోసైనేట్లు, పాలి యురేతేన్స్ (polyurethanes) ల ఉత్పత్తికి పుర్వ గామిగా పనిచేయును.
కార్బొనేట్ల సంశ్లేషణ
[మార్చు]కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ను బిస్ఫినోల్A తో చర్య జరపడం వలన పాలికార్బొనేట్లు ఏర్పడును. పాలికార్బొనేట్లను థెర్మోప్లాస్టిక్ నిర్మాణంలో ఉపయోగిస్తారు. డైయోల్స్ (Diols) లు ఫాస్జెన్ తో చర్యవలన సరళ (linear) లేదా చక్రీయ (cyclic) కార్బొనేట్లను (R = H, alkyl, aryl) ఏర్పరచును.
- HOCR2-X-CR2OH + COCl2 → 1/n [OCR2-X-CR2OC(O)-]n + 2 HCl
ఐసోసైనేట్ ల సంశ్లేషణ
[మార్చు]కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ ను అమిన్స్తో, ఎలెక్ట్రో ఫిలిక్ చర్యవలన ఐసోసైనేట్లను ఉత్పత్తి చెయ్యుదురు.
- RNH2 + COCl2 → RN=C=O + 2 HCl (R = alkyl, aryl)
ఇటువంటి రసాయన చర్యలను చర్యలను పిరిడీన్ ( pyridine) వంటి క్షారముసమక్షంలో జరుపుతారు. క్షారము హడ్రోజన్ క్లోరైడ్ను శోషించుకొనును.
పరిశోధనశాలలో కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ఉపయోగం
[మార్చు]కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ ను పరిశోధనశాలలో ఇప్పటికీ సేంద్రియపదార్థాలను సంశ్లేషణ చెయ్యుటలో మితంగా (limited ) వాడెదరు. పరిశోధనశాల స్థాయిలో ఉత్పత్తి కావించిన సేంద్రియ పదార్థాలలో, గది ఉష్ణోగ్రత వద్ద ద్రవ రూపంలో ఉండు ట్రైక్లోరోమిథైల్ క్లోరోఫార్మేట్ (డై ఫాస్జెన్ ) ఒకటి. అలాగే స్పటికంగా లభించు మరో సంయోగ పదార్థం బిస్ (ట్రై క్లోరోమిథైల్) కార్బోనేట్ (ట్రై ఫాస్జెన్ ). పారిశ్రామికస్థాయిలో కార్బోక్సిలిక్ ఆమ్లాల నుండి ఆసిడ్ క్లోరైడ్, కార్బన్ డయాక్సైడ్లను కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ ద్వారా ఉత్పత్తి చెయ్యుదురు.
- RCO2H + COCl2 → RC(O)Cl + HCl + CO2
ఆసిడ్ క్లోరైడ్లు అమీన్లతో చర్యవలన అమైడ్లను .ఆల్కహాల్తో చర్య వలన ఎస్టర్లను ఏర్పరచును.అందువలన వీటిని రసాయన చర్యలో మధ్యంతర స్థాయి ఉత్పాదకాలుగా ఉపయోగిస్తారు.థైనైల్ క్లోరైడ్ ను ఈ ప్రక్రియలో సురక్షితముగా ఉపయోగిస్తారు. క్లోరో ఫార్మిక్ ఎస్టర్లను ఉత్పత్తి చెయ్యుటకై ఫాస్జెన్ వాయువును ఉపయోగిస్తారు.
- ROH + COCl2 → ROC(O)Cl + HCl
కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ను ఎప్పుడు లోహసిలెండరులలో నిల్వ చెయ్యుదురు.
ఇతర రసాయన చర్యలు
[మార్చు]కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ మాములుగా జలవికర్షిణి (hydrophobic) అయినప్పటికీ నీటితో చర్య జరిపి హైడ్రోజన్ క్లోరైడ్, కార్బన్ డయాక్సైడ్లను ఏర్పరచును.
- COCl2 + H2O → CO2 + 2 HCl
అదేవిధంగా అమ్మోనియాతో కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ చర్య వలన యూరియాను ఉత్పన్న చెయ్యవచ్చును
- COCl2 + 4 NH3 → CO(NH2)2 + 2 NH4Cl
రసాయన యుద్ధ ఆయుధంగా
[మార్చు]రెండవ ప్రపంచ యద్దకాలంలో కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ను విస్తృతంగా రసాయన ఆయుధంగా వాడటం వలన, చాలా దేశాలు భారీగా ఈ వాయువును రహస్యంగా పెద్దఎత్తున నిల్వ చేసారు. 1928లో సెంట్రల్ హాంబర్గ్ లోని ఇలాంటి రహస్య ఆయుధాగారం నుండి 11 టన్నుల ఫొస్జీన్ వాయువు బయటకు వ్యాపించటం వలన చాల మంది దాని విష ప్రభావానికి లోనవగా, అందులో 10 మంది మృత్యు వాత పడ్డారు.
రెండవ సినో–జపాన్ యుద్ధంలో, నాటి ఇంపీరియల్ జపానీస్ ఆర్మీ ఈ ఫాస్జీన్ కలిగిన రసాయన ఆయుధాలను తరచుగా ఉపయోగించింది. 1938 లోఆగస్టు నుండి అక్టోబరు వరకు జరిగిన బాటిల్ ఆఫ్ వూహన్ (Battle of Wuhan) లో 731 సార్లు వివిధ సందర్భాలలో ఉపయోగించినట్లు చక్రవర్తి తెలిపాడు.
రక్షణ-భద్రత
[మార్చు]కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ ప్రచ్ఛన్నమైన విషకారి. ఈ వాయువును గుర్తించలేనందున దీని విష ప్రభావానికి గురైన తరువాత నెమ్మదిగా దీని ప్రభావం ఆనవాళ్ళు తెలుస్తాయి.ఊపిరితిత్తులలోని వాయు మారకము ప్రాతంలోని ప్రోటీను లపై కార్బొనైల్ క్లోరైడ్/ఫాస్జెన్ విషప్రభావాన్ని కల్గిస్తుంది. ఫలితంగా ఊపిరితిత్తులలోనిశ్వాసకు ఇబ్బంది కలుగు తుంది, ఉపిరి అందక ఉక్కిరిబిక్కిరి అవుతారు.ఫాస్జెన్ అమినో ప్రోటీన్లులతో యురియా బంధం వంటి క్రాస్ లింకుఏర్పరచుకోవటం వలన ఈ అనర్థం జరుగును. కార్బొనైల్ క్లోరైడ్/ఫాస్జీన్ ఉన్న ప్రాంతంలో పనిచేయు వారు దానిని గుర్తించు బాడ్జిలను ధరిస్తారు.
ఒకవేళ ద్రవ ఫాస్జీన్ బయట ఒలికిన, దానిని తటస్థ పరచుటకై సోడియం బై కార్బొనేట్ను ఉపయోగిస్తారు, వాయురూపంలో బయటకు వ్యాపించిన, దాని ప్రభావాన్ని తగ్గించుట కై అమ్మోనియాను ఉపయోగిస్తారు.
ఇవి కూడా చూడండి
[మార్చు]మూలాలు
[మార్చు]- ↑ Merck Index, 11th Edition, 7310.
- ↑ 2.0 2.1 2.2 2.3 2.4 NIOSH Pocket Guide to Chemical Hazards. "#0504". National Institute for Occupational Safety and Health (NIOSH).
- ↑ http://www.inchem.org/documents/icsc/icsc/eics0007.htm
- ↑ 4.0 4.1 "Phosgene". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).