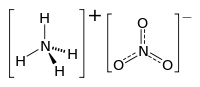
అమ్మోనియం నైట్రేట్
| |
| |

| |
| పేర్లు | |
|---|---|
| IUPAC నామము
Ammonium nitrate
| |
| గుర్తింపు విషయాలు | |
| సి.ఎ.ఎస్. సంఖ్య | [6484-52-2] |
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | BR9050000 |
| SMILES | [O-][N+]([O-])=O.[NH4+] |
| |
| ధర్మములు | |
| (NH4)(NO3) | |
| మోలార్ ద్రవ్యరాశి | 80.052 g/mol |
| స్వరూపం | white/grey solid |
| సాంద్రత | 1.725 g/cm3 (20 °C) |
| ద్రవీభవన స్థానం | 169.6 °C (337.3 °F; 442.8 K) |
| బాష్పీభవన స్థానం | approx. 210 °C;decomposes |
| 118 g/100 ml (0 °C) 150 g/100 ml (20 °C) 297 g/100 ml (40 °C) 410 g/100 ml (60 °C) 576 g/100 ml (80 °C) 1024 g/100 ml (100 °C)[1] | |
| నిర్మాణం | |
స్ఫటిక నిర్మాణం
|
trigonal |
| Explosive data | |
| Shock sensitivity | very low |
| Friction sensitivity | very low |
| ప్రమాదాలు | |
| ప్రధానమైన ప్రమాదాలు | Explosive |
| భద్రత సమాచార పత్రము | ICSC 0216 |
| ఇ.యు.వర్గీకరణ | {{{value}}} |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
2085–5300 mg/kg (oral in rats, mice)[2] |
| సంబంధిత సమ్మేళనాలు | |
| ఇతరఅయాన్లు | {{{value}}} |
ఇతర కాటయాన్లు
|
Sodium nitrate Potassium nitrate Hydroxylammonium nitrate |
సంబంధిత సమ్మేళనాలు
|
Ammonium perchlorate |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
అమ్మోనియం నైట్రేట్ ఒక రసాయనిక సమ్మేళనం. దీనిని అమ్మోనియం యొక్క నైట్రేట్ లవణం అనికూడా అంటారు.అమ్మోనియం నైట్రేట్ను సాధారణంగా ఎరువుల తయారీలో వినియోగిస్తారు. కానీ గనులు, భవన నిర్మాణాలకు జరిపే పేలుళ్లలోనూ దీన్ని వాడుతున్నారు.దీనిని వైద్య సేవల్లో కూడా ఉపయోగిస్తున్నారు.
భౌతిక ధర్మాలు
[మార్చు]ఇది ఒక అకర్బన రసాయన సమ్మేళనం. అమ్మోనియం నైట్రేట్ తెల్లగా లేదా బూడిదరంగులో ఉండు ఘన పదార్థం. దీని యొక్క అణుభారం/మోలార్ భారం 80.09గ్రాములు/మోల్−1. ఈ సమ్మేళనపదార్థం యొక్క సాంద్రత, (20Cవద్ద) 1.725 గ్రాములు/సెం.మీ3.ద్రవీభవన స్థానం 169.6 °C (337.3 °F; 442.8 K) . ఈ సమ్మేళనం యొక్క బాష్పిభావ స్థానం అందాజుగా 210 °C, ఈ ఉష్ణోగ్రత వద్ద, ఈ సమ్మేళనం వియోగం చెందును. రసాయనిక ఫార్ములా NH4NO3, దీనినే క్లుప్తంగా N2H4O3.అనికూడా వ్యవహరిస్తారు. అమ్మోనియం నైట్రేట్ నీటిలో బాగాకరుగుతుంది.
రసాయన చర్యలు
[మార్చు]అమ్మోనియం నైట్రేట్ లోహ ఆక్సైడ్ లతో రసాయనిక చర్య జరపడం వలన క్షార లోహ నైట్రేట్ ఏర్పడి, అమ్మోనియా వాయువు విడుదల అగును.
- NH4NO3 + MOH → NH3 + H2O + MNO3 (M = Na, K)
అమ్మోనియం నైట్రేట్ సమ్మేళనం హైడ్రోక్లోరిక్ ఆమ్లంతో చర్య వలన అమ్మోనియం క్లోరైడ్, నైట్రిక్ ఆమ్లాన్ని ఏర్పరచును.
- NH4NO3 + HCl → NH4Cl + HNO3
ఉనికి
[మార్చు]చిలే దేశంలోని అటకామా ఎడారిలో అమ్మోనియం నైట్రేట్ స్వాభావిక స్థితిలో లభ్యమగును.ఇది లేదా సోడియం నైట్రేట్ వంటి కొన్ని నైట్రేట్ ఖనిజాలతో కలిసిలేదా విడిగా లభిస్తుంది. గతంలో ఇక్కడ అధిక మొత్తంలో త్రవ్వకం జరిపేవారు ప్రస్తుతం 100% కృత్తిమంగా అమ్మోనియం నైట్రేట్ ను ఉత్పత్తి చేస్తున్నారు.
ఉత్పత్తి
[మార్చు]అమ్మోనియాను, నైట్రిక్ యాసిడ్ను కలపడం వల్ల ఏర్పడిన సింథటిక్ పదార్ధమే అమ్మోనియం నైట్రేట్, దీనిని వ్యాపారాత్మకముగా అమ్మోనియం నైట్రేట్ను ఆమ్లం -క్షార చర్యానుగతంగా అమ్మోనియాన్ని నత్రజని ఆమ్లంతో చర్య జరిగే లా చేసి ఉత్పత్తి చేయుదురు.
- HNO3 + NH3 → NH4NO3
అమ్మోనియం నైట్రేట్ ఉత్పత్తి కై ఉపయోగించు అమ్మోనియం వాయువు ఎటువంటి చెమ్మను లేకుండా పొడిగా ఉండాలి. అలాగే ఉపయోగించు నత్రికామ్లం/నైట్రిక్ ఆసిడ్ గాఢత కలిగిఉండాలి. ఈ రెండు రసాయనాల మధ్య చర్య జరుగునప్పుడు అధిక మొత్తంలో ఉష్ణం విడుదల (exothermic) అగును. అందుచే చర్యా సమయంలో పరిస్థితులు చాలా తీవ్రంగాఉండును. చర్యానంతరం 83%గాఢతతో అమ్మోనియం నైట్రేట్ ద్రవం ఏర్పడును. ద్రవంలోని నీటిని బాష్పికరించి అమ్మోనియం నైట్రేట్ గాఢతను 95 -99 .9% వరకు వచ్చేలా చెయ్యుదురు. ఇప్పుడు గాఢత చెందిన అమ్మోనియం నైట్రేట్ను ఎత్తులో ఉన్న స్ప్రే టవరు నుండి క్రిందకు పిచికారి చేసి గోళాకార గుళికలు అయ్యేలా చెయ్యుదురు.ఏర్పడిన గుళికలను మరింత పొడి పరచి, చల్లబరచెదరు.
అమ్మోనియం నైట్రేట్ ఉత్పత్తికి అవసరమైన అమ్మోనియా వాయువును హబెర్ పద్ధతి (Haber process) లో నత్రజని, హైడ్రోజన్ వాయువుల సంగమం వలన ఉత్పత్తి చేయుదురు.
అమ్మోనియం నైట్రేట్ ను మెటాథిసిస్ ప్రతిచర్య పద్ధతిలో కూడా తయారు చెయ్యవచ్చును.
- (NH4)2SO4 + 2 NaNO3 → 2 NH4NO3 + Na2SO4
- (NH4)2SO4 + Ca(NO3)2 → 2 NH4NO3 + CaSO4
పై పద్ధతిలో అమ్మోనియం నైట్రేట్ తో పాటుగా ఏర్పడిన సోడియం సల్ఫేట్ ను, ఏర్పడిన మిశ్రమ జనితఉత్పత్తుల (products) ఉష్ణోగ్రతను తగ్గించడం వలన తొలగించ వచ్చును. అమ్మోనియం కన్న అతి తక్కువ పరిమాణంలో సోడియం సల్ఫేట్ నీటిలో కరుగు స్వభావం కలిగి ఉన్నందున జనిత మిశ్రమాన్ని చల్లార్చడం వలన సోడియం సల్ఫేట్ అవక్షేపంగా ఏర్పరచి తొలగించెదరు.
భద్రత
[మార్చు]అమ్మోనియం నైట్రేట్ ప్రేలుడు లక్షణాలను కలిగి ఉండటం వలన దీనిని నిల్వ ఉంచునప్పుడు తగిన రక్షణ, భద్రత చర్యలను పాటించవలెను.అమ్మోనియం నైట్రేట్ను వేడి చేసిన లేదా ఈ పదార్థానికిదగ్గరగా మండే స్వభావమున్న వస్తువులు వుండి మండటం వలన అమ్మోనియం నైట్రేట్ పెద్ద ప్రేలుడుతో మండు అవకాశం ఉంది. అమ్మోనియం నైట్రేట్ యొక్క క్రిటికల్ రిలేటివ్ హ్యుమిడిటి 59.4%.వాతావరణంలో అంతకు మించి తేమ/హ్యుమిడిటి ఉన్నచో అమ్మోనియం నైట్రేట్ వాతావరణంలోని తేమను పీల్చుకుని ముద్దగా అవును. అందుచే అమ్మోనియం నైట్రేట్ ను తేమ, గాలి అందని విధంగా నిల్వ చెయ్యాలి.సాధారణ పరిస్థితుల్లో అమ్మోనియం నైట్రేట్ పేలదు. కానీ అది ఇతర రసాయనాలతో కలిస్తే ప్రమాదం , ఉష్ణోగ్రత సుమారు 270 డిగ్రీల సెంటీగ్రేడ్ దాటినప్పుడు మాత్రమే ఆ లవణం మండుతుంది.[3] 04 ఆగస్టు 2020 న లెబనాన్ రాజధాని బీరుట్లో భారీ పేలుడుకు అమ్మోనియం నైట్రేట్ కారణం లెబనాన్లోని బేరూత్ పోర్ట్లో ఆరేళ్ల కిందట ఒక ఓడ నుంచి దింపిన సుమారు 3,000 టన్నుల అమ్మోనియం నైట్రేట్ను రేవు సమీపంలోని ఓ గోదాంలో ఉంచారు. ఇందులో దాదాపు 100 మందికి పైగా ప్రాణాలు కోల్పోయారు వేలమంది గాయపడ్డారు.
ఆరోగ్యంపై ప్రభావం
[మార్చు]అమ్మోనియం నైట్రేట్ ఆరోగ్య పరంగా అంత ప్రమాదకారి కానప్పటికి ఉపయోగించునప్పుడు తగుజాగ్రత్తలు తీసుకోవాలి. కొద్ది సమయం పాటు అమ్మోనియం నైట్రేట్ తో సంపర్కం వలన, దాని ప్రభావానికి గురై నప్పుడు తాత్కాలికముగా తలతిప్పడం, వాంతులు, తలనొప్పి, దృష్టి మసక బారటం వంటి లక్షణాలు కలుగును. జీర్ణవ్యవస్థ లోకి వెళ్ళిన చర్మాన్ని తాకినా, కళ్ళలోపడిన, లేదా వాసన పిలచిన కొద్దిపాటి అనారోగ్య ప్రమాద లక్షణాలు కనిపించును. ఎక్కువ కాలం అమ్మోనియం నైట్రేట్ ప్రభావానికి గురైన క్యాన్సరు వచ్చే అవకాశం ఉంది.
ఉపయోగాలు
[మార్చు]అమ్మోనియం నైట్రేట్ ను వ్యవసాయంలో అధిక ప్రమాణంలో నత్రజనిని అందించు రసాయనిక ఎరువుగా ఉపయోగిస్తారు. అలాగే గనులలో, క్వారీ లలో ప్రేలుడు మందుగా ఉపయోగిస్తారు. అంతియే కాకుండా కొన్ని అభివృద్ధి పరచిన ప్రేలుడు పరికరాలలో కుడా ఉపయోగిస్తారు.ఉత్తర అమెరికాలో వాడు ANFOఅను ప్రేలుడు మందులో అధిక మొత్తంలో (80 %) అమ్మోనియం నైట్రేట్ ను ఉపయోగిస్తారు.ఈ సమ్మేళనాన్ని హైడ్రే టింగ్ చేసిన ఉష్ణ గ్రాహక చర్య చోటు చేసుకోనును.అందుచే అమ్మోనియం నైట్రేట్ ను తక్షణ శితలీరణ ప్యాక్ లలో కూడా ఉపయోగిస్తారు.అమ్మోనియం నైట్రేట్ తో తయారు చేసిన పేలుడు పదార్ధాలను సైనిక దళాలు ప్రపంచవ్యాప్తంగా వాడుతున్నాయి. తీవ్రవాదులు కూడా దీన్ని పేలుళ్ల కోసం వాడుతుంటారు.[4]
ఎరువుగా
[మార్చు]అమ్మోనియం నైట్రేట్ ఒక ప్రధానమైన రసాయనిక ఎరువు. దీని NPK విలువ 34-0-0 (34%నత్రజని) . దీనిలోని నత్రజని శాతం యూరియాకన్న తక్కువ (యూరియాలో నత్రజని 46%) . యూరియా కన్న అమ్మోనియం నైట్రేట్ ఎక్కువ స్థిరత్వం కలిగి వాతావరణం లోకి నత్రజనిని నెమ్మదిగా విడుదల చేయును. పొలాలలో వర్షాలు కురువక ముందే, వెచ్చిని వాతావరణం ఉన్నప్పుడే ఈ రసాయనాన్ని వాడటం వలన నత్రజని నష్టశాతాన్ని తగ్గించవచ్చును
మూలాలు
[మార్చు]- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. p. 362. ISBN 1-903996-65-1.
- ↑ "అమ్మోనియం నైట్రేట్: విశాఖ రేవుకు జోరుగా దిగుమతులు, విజయవాడలో భారీ నిల్వలు". BBC News తెలుగు. Retrieved 2020-08-10.
- ↑ "అమ్మోనియం నైట్రేట్ అంటే ఏమిటి.. అది ఎంత ప్రమాదకరం". BBC News తెలుగు. Retrieved 2020-08-10.
