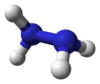
హైడ్రాజీన్
| |||
| |||
 Hydrazine hydrate
| |||
| పేర్లు | |||
|---|---|---|---|
| IUPAC నామము
Hydrazine[2]
| |||
| Systematic IUPAC name
Diazane[2] | |||
| ఇతర పేర్లు | |||
| గుర్తింపు విషయాలు | |||
| సి.ఎ.ఎస్. సంఖ్య | [302-01-2] | ||
| పబ్ కెమ్ | 9321 | ||
| యూరోపియన్ కమిషన్ సంఖ్య | 206-114-9 | ||
| కెగ్ | C05361 | ||
| వైద్య విషయ శీర్షిక | Hydrazine | ||
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:15571 | ||
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | MU7175000 | ||
| SMILES | NN | ||
| |||
| బైల్ స్టెయిన్ సూచిక | 878137 | ||
| జి.మెలిన్ సూచిక | 190 | ||
| 3DMet | B00770 | ||
| ధర్మములు | |||
| N2H4 | |||
| మోలార్ ద్రవ్యరాశి | 32.0452 g/mol | ||
| స్వరూపం | Colorless, fuming, oily liquid[3] | ||
| వాసన | Ammonia-like[3] | ||
| సాంద్రత | 1.021 g/cm3 | ||
| ద్రవీభవన స్థానం | 2 °C; 35 °F; 275 K | ||
| బాష్పీభవన స్థానం | 114 °C; 237 °F; 387 K | ||
| Miscible[3] | |||
| log P | 0.67 | ||
| బాష్ప పీడనం | 1 kPa (at 30.7 °C) | ||
| ఆమ్లత్వం (pKa) | 8.10 ([N2H5]+)[4] | ||
| Basicity (pKb) | 5.90 | ||
| వక్రీభవన గుణకం (nD) | 1.46044 (at 22 °C) | ||
| స్నిగ్ధత | 0.876 cP | ||
| నిర్మాణం | |||
| Triangular pyramidal at N | |||
ద్విధృవ చలనం
|
1.85 D[5] | ||
| ఉష్ణగతిక రసాయన శాస్త్రము | |||
| నిర్మాణము మారుటకు కావాల్సిన ప్రామాణిక ఎంథ్రఫీ ΔfH |
50.63 kJ/mol | ||
| ప్రామాణిక మోలార్ ఇంథ్రఫీ S |
121.52 J/(K·mol) | ||
| ప్రమాదాలు | |||
| భద్రత సమాచార పత్రము | ICSC 0281 | ||
| జి.హెచ్.ఎస్.పటచిత్రాలు |     
| ||
| జి.హెచ్.ఎస్.సంకేత పదం | DANGER | ||
| జి.హెచ్.ఎస్.ప్రమాద ప్రకటనలు | H226, H301, H311, H314, H317, H331, H350, H410 | ||
| GHS precautionary statements | P201, P261, P273, P280, P301+310, P305+351+338 | ||
| జ్వలన స్థానం | {{{value}}} | ||
స్వయం జ్వలన
ఉష్ణోగ్రత |
24 నుండి 270 °C (75 నుండి 518 °F; 297 నుండి 543 K) | ||
| విస్ఫోటక పరిమితులు | 1.8–99.99% | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose)
|
59–60 mg/kg (oral in rats, mice)[6] | ||
LC50 (median concentration)
|
260 ppm (rat, 4 hr) 630 ppm (rat, 1 hr) 570 ppm (rat, 4 hr) 252 ppm (mouse, 4 hr)[7] | ||
| US health exposure limits (NIOSH): | |||
PEL (Permissible)
|
TWA 1 ppm (1.3 mg/m3) [skin][3] | ||
REL (Recommended)
|
Ca C 0.03 ppm (0.04 mg/m3) [2-hour][3] | ||
IDLH (Immediate danger)
|
Ca [50 ppm][3] | ||
| సంబంధిత సమ్మేళనాలు | |||
| ఇతరఅయాన్లు | {{{value}}} | ||
ఇతర కాటయాన్లు
|
Organic hydrazines | ||
| Related {{{label}}} | {{{value}}} | ||
సంబంధిత సమ్మేళనాలు
|
Diazene Triazene Tetrazene Diphosphene | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||
హైడ్రాజీన్ అనునది ఒక అకర్బన రసాయన సంయోగ పదార్థం.వ్యవస్థపరమైన పేరు డైఆజాన్ లేదా టెట్రాహైడ్రిడో డైనైట్రోజన్ (N-N). ఈ సంయోగపదార్థం యొక్క రసాయనసంకేత పదం H2NNH2 (N2H4అనికూడా వ్రాస్తారు).ఇది రంగులేని మండేలక్షణము ఉన్న ద్రవం.అమ్మోనియా వాయువు వంటి వాసన కలిగిఉన్నది. హైడ్రాజీన్ అధిక విష ప్రభావమున్న రసాయనపదార్థం, హైడ్రాజీన్ స్థిరమైనది, కావున ద్రవరూపంలో జాగ్రత్తగా భద్రపరచవలెను. 2000 సంవత్సరం నాటికి ప్రపంచ వ్యాప్తంగా 0.12మిలియను టన్నుల హైడ్రాజీన్ హైడ్రేట్ (నీటి బరువుతో లెక్కించిన 64% హైడ్రాజీన్ ద్రవం) ప్రతి సంవత్సరం ఉత్పత్తి అవుతున్నది.
హైడ్రాజీన్ను ముఖ్యంగా పాలిమర్ ఫోమ్స్ తయారు చెయ్యుటలో ఫోమింగ్ కారకంగా ఉపయోగిస్తున్నారు.పాలిమరైజెసన్ ఉత్ప్రేరకాలలో, ఔషధ ఉత్పాదకాల తయారికి పుర్వగామి (precursor) గా కూడా విస్తృతంగానే వాడుచున్నారు.రాకెట్ ఇంధనాలలో కూడా ఉపయోగిస్తారు.ఎయిర్బ్యాగ్లలో నింపే వాయువులను ఉత్పత్తి చెయ్యుటకు పుర్వగామిగా వాడెదరు.హైడ్రాజీన్ను న్యూక్లియర్, సాంప్రదాయ విద్యుత్తు ఉత్పత్తికేంద్రాలలో, నీటి ఆవిరిలోని కరిగి ఉన్న ఆక్సిజన్ను తొలగించుటకై ఆక్సిజన్ స్కావెంజరుగా ఉపయోగిస్తారు.
చరిత్ర
[మార్చు]1875 లో ఎమిల్ ఫిస్చెర్, మొనో సబ్స్టి ట్యుట్ హైడ్రాజీన్కలిగిన సేంద్రియ సంయోగ పదార్థాలను కనుగొను ప్రయత్నంలో హైడ్రాజీన్ అను పదాన్నివాడుకలోకి తెచ్చాడు. థియోడర్ కర్టియస్ (Theodor Curtius )1887 లో సజల సల్ఫ్యూరిక్ ఆమ్లంతో సేంద్రియ డైఅజిడు (diazide) ను చర్య జరిపించడం ద్వారా హైడ్రాజీన్ సల్ఫేట్ను ఉత్పత్తి చేసాడు.ఇయన పలుమార్లు ప్రయత్నించినను శుద్ధ హైడ్రాజీన్ను తయారు చెయ్య లేక పోయాడు. డచ్ శాస్త్రవేత్త లోబ్రి డి బ్రుయ్న్ (Lobry de Bruyn )1895లో శుద్ధనిర్జల హైడ్రాజీన్ ను తయారు చేసాడు.
భౌతిక లక్షణాలు
[మార్చు]హైడ్రాజీన్ రంగు లేని, పొగలువచ్చు, జిడ్డుగా ఉండే ద్రవం.అమ్మోనియా వంటి వాసన కలిగిఉండును.హైడ్రాజీన్ యొక్క అణుభారం 32.045 గ్రాములు/మోల్.హైడ్రాజీన్ యొక్క సాంద్రత 1.021 గ్రాములు/సెం.మీ3.ఈ రసాయనసమ్మేళనం యొక్క ద్రవీభవన స్థానం 2 °C (35 °F; 275K)., ఈ రసాయన సమ్మేళనద్రవం యొక్క బాష్పీభవన స్థానం 114 °C; (237 °F; 387 K).హైడ్రాజీన్ నీటిలో కలుస్తుంది.ఈ రసాయన సమ్మేళనద్రవం యొక్కవక్రీభవన సూచిక 1.46044 (22 °Cవద్ద). హైడ్రాజీన్ స్నిగ్ధత/చిక్కతనం (viscosity) 0.876 cP. హైడ్రాజీన్ ఆవిరి/బాష్ప వత్తిడి 1 kP (at 30.7 °C).హైడ్రాజీన్ యొక్క అమ్లత్వం (pKa) :8.10, క్షారత్వము (pKb) :5.90
అణు సౌష్టవం-ధర్మాలు
[మార్చు]నిర్జల హైడ్రాజీన్ కన్న మొనో హైడ్రేట్/ఆర్ద్రహైడ్రాజీన్ (ఒక జలఅణువు కలిగిన) అధిక సాంద్రత (1.032గ్రాములు/సెం.మీ3.) కలిగి ఉంది.ఒక హైడ్రోజన్ పరమాణువును వదులు కొని, రెండు అమ్మోనియా పరమాణువులు జతకూడటం వలన హైడ్రాజీన్అణువు ఏర్పడును.ప్రతి H2N-N ఉపభాగం పిరమిడ్ ఆకారాన్ని కలిగిఉండును. N-Nయొక్క ఏకబంధదూరం 1.45 Å (145 pm), హైడ్రాజీన్ అణువు గూచ్ కన్ఫర్మసన్ (gauche conformation) కు అనుగుణ్యత కలిగిఉండును.అణువు యొక్క రోటేసనల్ బారియర్ ఇథేన్ కన్న రెండింతలు ఉండును.ఈ నిర్మాణ/సౌష్టవ ధర్మాలు వాయుయుత హైడ్రోజన్ పెరాక్సైడుతో సాదృశ్యముకలిగి ఉండును.
హైడ్రాజీన్ యొక్క రసాయన క్షారధర్మాలు అమ్మోనియా క్షారగుణాలతో సరిపోల్చదగిన విధంగా ఉండును.
- N2H4 + H2O → [N2H5]+ + OH−
ప్రతిక్షేప విలువలు:
- Kb = 1.3 x 10−6
- pKa = 8.1
అమ్మోనియాకు విలువ Kb = 1.78 x 10−5
హైడ్రాజీన్ను డిప్రోటోనేట్ చెయ్యడం కష్టతరమైనది.
- [N2H5]+ + H2O → [N2H6]2+ + OH− Kb = 8.4 x 10−16
ఆక్సిజతో (గాలి) హైడ్రాజీన్ యొక్క దహనఉష్ణం విలువ: 1.941 x 107 J/kg (9345 BTU/lb).
హైడ్రాజీన్ సంశ్లేషణ –ఉత్పత్తి
[మార్చు]హైడ్రాజీన్ సంశ్లేషణను చెయ్యుటకై చాలా సంవత్సారాలుగా పలు ఉత్పత్తిప్రక్రియలను అభివృద్ధి పరచడం జరిగింది.ఈ సంశ్లేషణ పద్ధతులలో ముఖ్యమైన మెట్టు నైట్రోజన్-నైట్రోజన్ పరమాణువు మధ్య ఏక బంధాన్ని సృష్టించడం.ఒలిన్ రాచిగ్ ప్రక్రియలో క్లోరిన్ ఆధారిత ఆక్సీకరణిలు, అమ్మోనియన్ కిటోనుల అవసరం లేకుండానే ఆక్సీకరణం చెయ్యును. పెరాక్సైడ్ ప్రక్రియవిధానంలో కిటోన్ సమక్షంలో హైడ్రోజన్ పెరాక్సైడ్, అమ్మోనియాను అక్సీకరించును.
హైపోక్లోరైట్ అమ్మోనియాను ఉపయోగించి
[మార్చు]ఒలిన్ రాచిగ్ విధానంలో సోడియం హైపోక్లోరైట్, అమ్మోనియాను ఉపయోగించి హైడ్రాజీన్ను తయారుచెయ్యుదురు.ఈ ప్రక్రియ విధానాన్ని 1907 సంవత్సరంలో కనుగొన్నారు.ఈ విధానంలో క్లోరో మిన్ (chloroamine), అమ్మోనియాతో కలిసి చర్యజరపడం వలన, నైట్రోజన్-నైట్రోజన్ పరమాణువు మధ్య ఏకబంధాన్ని సృష్టించబడటం వలన హైడ్రాజీన్ ఉత్పత్తిగా, హైడ్రోజన్ క్లోరైడ్ ఉపఉత్పత్తిగా ఏర్పడును.
- NH2Cl + NH3 → H2N-NH2 + HCl
రాచిగ్ ఉత్పత్తి ప్రక్రియవిధానంలోనే అమ్మోనియా వాయువుకు బదులుగా యురియాను ఆక్సీకరణచెయ్యడం ద్వారా హైడ్రాజీన్ను ఉత్పత్తి చెయ్యవచ్చును.ఈ ప్రక్రియలో కూడా సోడియం హైపోక్లోరైట్ ను ఆక్సీకరణిగా ఉపయోగిస్తారు.రసాయన చర్య దిగువ చూపిన విధంగా జరుగును.
- (H2N)2C=O + NaOCl + 2 NaOH → N2H4 + H2O + NaCl + Na2CO3
ఈ పై విధానంలో పలు ఉపఉత్పత్తులు ఏర్పడును.
అసిటోన్ సమక్షంలో,అమ్మోనియాను క్లోరోఅమిన్ ద్వారా ఆక్సీకరణ చెయ్యడం వలన
[మార్చు]బేయర్ కేటజిన్ ప్రాసెస్ విధానం పెరాక్సైడ్ విధానానికి ముందుస్థితి (predecessor). ఈ విధానంలో హైడ్రోజన్ పెరాక్సైడ్ కు బదులుగా హైపోక్లోరైటును ఆక్సీకరణిగా ఉపయోగిస్తారు. హైపోక్లోరైట్ ఆధారిత మిగతా ప్రక్రియలవలె, ఈ విధానంలో కుడా హైడ్రాజీన్కు సమాన పరిమాణంలో లవణాలు ఉత్పత్తిఅగును.
పెరాక్సైడునుండి ఉత్పత్తిఅయ్యిన అక్సాజిరిడిన్ ద్వారా అమ్మోనియాను అక్సీకరించడం
[మార్చు]పెరాక్సైడ్ పద్ధతిలో అమ్మోనియాను హైడ్రోజన్పెరాక్సైడుతో ఆక్సీకరణచెయ్యడం వలన హైడ్రాజీన్ను ఉత్పత్తి చెయ్యవచ్చును.అంతిమచర్య ఫలితం దిగువన పేర్కొన్నట్లు ఉండును.
- 2 NH3 + H2O2 → H2N-NH2 + 2 H2O
ఈ విధానంలో అమ్మోనియా, హైడ్రోజన్పెరాక్సైడు, అసిటోన్ లేదా మిథైల్ ఇథైల్ కిటోన్లతో పలుదశలలో హైడ్రాజీన్ను తయారుచేయుదురు. మొదట కిటోన్, అమ్మోనియాలను ద్రవికరించడంచే ఏర్పడిన ఇమిన్ (imine) ను హైడ్రోజన్పెరాక్సైడ్ తో ఆక్సీకరణ వలన అక్సాజిరిడిన్ (కార్బన్, ఆక్సిజన్, నైట్రోజన్లను కలిగిన వలయ సమ్మేళనము) ఏర్పడును. ఈ అక్సాజిరిడిన్ను అమ్మోనియాతో ట్రీట్ చెయ్యడం వలన నైట్రోజన్-నైట్రోజన్ పరమాణువుల మధ్య ఏకబంధమున్న హైడ్రాజోన్ (hydrazone) ఏర్పడును. ఈ హైడ్రాజోన్ సమాన పరిమాణమున్న కిటోన్ తో ద్రవీకరణ వలన ఏర్పడిన అజీన్ (azine) జలవిశ్లేషణ వలన హైడ్రాజీన్ అంతిమంగా ఏర్పడును.
ఉపయోగాలు
[మార్చు]బ్లోవింగ్ ఏజెంట్ ల తయారీలో హైడ్రాజీన్ ను పుర్వగామి (precursor) గా ఉపయోగిస్తారు.అజోడికార్బన్ అమిడ్, azobisisobutyronitrile వంటి ప్రత్యేక సంయోగపదార్థాల తయారిలో ఉపయోగిస్తారు. ఒకగ్రాము హైడ్రాజీన్ పుర్వగామినుండి 100-200 మి.లీ వాయువు ఉత్పత్తిఅగును.ఎయిర్బ్యాగ్లలో వాయు ఉత్పత్తి కారకంగా పనిచేయు సోడియం అజీడ్ (sodium azide) అను రసాయనం హైడ్రాజీన్తో, సోడియం నైట్రేట్ చర్య వలన ఏర్పడును.అంతరిక్షవాహనాల్లో హైడ్రాజీన్ను చోదకం చాలక (propellant గా వాడెదరు.పరిశ్రమలలో వాడు పెద్ద బాయిలర్లలో ఉపయోగించు నీటిలోని కరిగిన ఆక్సిజన్ ను తొలగించి, నీటి pHని నియంత్రణలో ఉండుటకు దోహదపడును.
f-16 యుద్ధ జెట్ విమానంలో అత్యవసర విద్యుత్ జనకయూనిట్లో ఇంధనంగా హైడ్రాజీన్ను ఉపయోగిస్తారు.
ఔషధ, క్రిమి సంహారక మందుల తయారి
[మార్చు]ఔషధ, క్రిమిసంహారక మందుల తయారిలో హైడ్రాజీన్ పుర్వగామిగా, ఉత్పత్తి మూలవనరుగా పనిచేయును.ముఖ్యంగా 3-అమినో-1,2,4-ట్రైజోల్, మాలిక్ హైద్రాజిడ్ ఉత్పత్తి చెయ్యుచున్నారు.అలాగే అంటి ట్యుబులర్డ్రగ్ ఐసోనిఅజిడ్ (isoniazid ) ను హైడ్రాజీన్ నుండి ఉత్పత్తి చెయ్యుదురు .
హైడ్రాజోన్ ఉత్పత్తి
[మార్చు]హైడ్రాజీన్ తో ప్రోపనోన్ రసాయనచర్య వలన అసిటోన్ అజీన్ (diisopropylidene hydrazine) ఏర్పడును. అసిటోన్ అజీన్ తిరిగి హైడ్రాజీన్తో రసాయన చర్యజరపడం వలన హైడ్రాజోన్ ఉత్పత్తి అగును.
- 2(CH3)2CO + N2H4 → 2 H2O + [(CH3)2C=N]2
- [(CH3)2C=N]2 + N2H4 → 2(CH3)2C=NNH2
సల్ఫోనేసను(Sulfonation)
[మార్చు]హైడ్రాజీన్ కేంద్రకఆకర్షిణి (nucleophile) కావడంచేత సల్ఫోనైల్ హైలైడులు, అకైల్ హలైడులతో రసాయన చర్య జరుపుతుంది.టోసిల్ హైడ్రాజీన్ ( tosylhydrazine) తో కార్బోనైల్స్ చర్య వలన హైడ్రాజోనులు ఏర్పడును.
హైడ్రాజీనియం లవణాలు
[మార్చు]ఖనిజఆమ్లాలతో హైడ్రాజీన్ను రసాయనికచర్య జరిపించడం వలన ఘన లవణాలుగా మార్చవచ్చును.ఇటువంటి ఒక లవణం హైడ్రాజీన్సల్ఫేట్ ([N2H5]HSO4, హైడ్రా జీనియం సల్ఫేట్ అనికూడా అంటారు.హైడ్రాజీన్, హిడ్రాజోయిక్ఆమ్లాల చర్య వలన ఏర్పడిన హైడ్రాజీన్ అజిడ్ (N5H5) ఎక్కువ పరిమాణంలో నైట్రోజనును కల్గి, ప్రేలుడు స్వభావం కలిగి ఉన్నందున సాంకేతపరంగా ప్రాముఖ్యత కలిగిఉన్నది. ఇది సౌష్టవపరంగా [N2H5]+[N3]−.గా ఉండి, విస్పోటక వియోగం చెందటం వలన హైడ్రాజీన్, అమ్మోనియా, నైట్రోజన్ వాయువు ఏర్పడును.
- 12 N5H5 → 3 N2H4 + 16 NH3 + 19 N2
హైడ్రాజీన్ తో సల్ఫ్యూరిక్ఆమ్లం చర్య వలన శుద్ధ హైడ్రాజీన్ సల్ఫేట్, హైడ్రాజోయిక్ ఆమ్లం ఏర్పడును.
హైడ్రాజీన్ ఇతర పారిశ్రామిక ఉపయోగాలు
[మార్చు]హైడ్రాజీన్ను చాలా రసాయనప్రక్రియలలో ఉపయోగిస్తారు.స్పాన్డెక్షు ఫైబరు ఉత్పత్తిలో, పాలిమెరిజేసన్ ఉత్ప్రేరకంగా, ఫ్యూయల్ సెల్స్లో, సోల్డరింగు ఫ్లక్సులలో, పోటోగ్రాఫిక్ డెవలపర్సులో ఉపయోగిస్తారు. హైడ్రాజీనును 70%హైడ్రాజీన్, 30% నీటి మిశ్రమద్రావణాన్ని లాక్హీడ్ F-16 ఫైటింగ్ ఫాల్కన్ యుద్ధవిమానం అత్యవసర విద్యుత్తు యూనిట్లో విద్యుత్తు ఉత్పాదకంగా ఉపయోగించారు.హైడ్రాజీన్ను తరచుగా భారి బాయిలరులలో లోహ క్షయికరణ నిలువరించు కారకంగా, ఆక్సిజన్ను తొలగించు కారకంగా వాడేవారు, కాని ఈ సంయోగపదార్థానికి ఉన్న విషగుణం కారణంగా వాడటం తగ్గించారు.
రాకెట్ ఇంధనంగా వినియోగం
[మార్చు]రెండవ ప్రపంచయుద్ధంలో Messerschmitt Me 163B అను రాకెట్పవర్డ్ యుద్ధవిమానంలో హైడ్రాజీన్ను B –stoff (హైడ్రాజీన్ హైడ్రేట్) అను పేరుతొ ఇంధనంగా ఉపయోగించారు. హైడ్రాజీన్ను మిథనాల్ (M-Stoff), నీటిలో మిశ్రమం చేసినపుడు C-stoff అంటారు.
అంతరిక్షరాకెట్ ల నియంత్రణ thruster లలో తక్కువ శక్తియుత ఏకచోదకం (mono propellant) ఉపయోగిస్తారు.అలాగే స్పేస్^సెటిల్ లోని ఆక్సిలరి పవర్^యూనిట్^లలో కుడా విద్యుతు జనకంగా ఉపయోగించారు.
మొనోప్రొపెల్లెంట్ (ఏక చోదక) ఇంజనులలో ఉపయోగించిన హైడ్రాజీన్ ఈదిగువచూపిన విధంగా, వివిధ రసాయనమార్పులకు లోనగును.
- 3N2H4 → 4NH3 + N2
- N2H4 → N2 + 2 H2
- 4 NH3 + N2H4 → 3 N2 + 8 H2
ఈ రసాయనచర్యలో మొదటి, రెండవ చర్యలు ఉష్ణ విమోచకచర్యలు (చర్య జరుగుచాంబరు/ ప్రాంతంలో 800°Cవరకు ఉష్ణోగ్రత, ఒకమిల్లి సెకండులో ఏర్పడుతుంది).అత్యధిక ఉష్ణోగ్రత కారణం వలన తక్కువ ద్రావణం/ద్రవం నుండి భారి ప్రమాణంలో వేడి వాయువులు ఉత్పన్నమగును/వెలువడును.ఈ కారణంగా హైడ్రాజీన్220 సెకండ్ల స్పెసిఫిక్ ఇంపల్సుతో సమర్ధవంతమైన త్రస్టరు ప్రొపెల్లెంట్ గా పనిచేస్తుంది.మూడవ చర్య ఉష్ణ గ్రాహకచర్య కావడం వలన ఉష్ణోగ్రత తగ్గినా పెద్దసంఖ్యలో అణువులను ఉత్పత్తి చెయ్యును.
రాకెట్ ఇంధనంగా ఉపయోగించుఇతర హైడ్రాజీన్ ఉత్పాదకాలు monomethylhydrazine, (CH3) NH (NH2), unsymmetrical dimethylhydrazine, ఈ ఇంధనాలను తరచుగానైట్రోజన్ టెట్రాక్సైడ్ (N2O4) తో కలిపి టుకంపోనెంట్ రాకెట్ఇంధనంగా ఉపయోగిస్తారు. (CH3)2N (NH2).
ఇస్రోవారు ప్రయోగించిన పిఎస్ఎల్వి-C4 ఉపగ్రహ వాహకనౌకలో అసౌష్టవ డైమిథైల్ హైడ్రాజీన్ (UDMH), నైట్రోజన్ టెట్రాక్సైడ్ (N2O4) లను చోదక ఇంధనాలుగా ఉపయోగించారు. డైమిథైల్ హైడ్రాజీన్ ను ఇంధనంగా, నైట్రోజన్ టెట్రాక్సైడ్ను ఆక్సీకరణిగా ఉపయోగించారు.
ప్రమాద స్వభావం
[మార్చు]హైడ్రాజీన్ అత్యంత విషగుణమున్న ప్రమాదకర రసాయనపదార్థం. యు.ఎస్.పరసరాల పరిరక్షణ ఏజెన్సిప్రకారం నిర్జల రూపంలో ఇది అస్థిరమైనది, ప్రమాదకారి కూడా.తక్కువ సమయంలో ఎక్కువమోతాదులో హైడ్రాజీన్ ప్రభావానికి గురైనప్పుడు, కళ్ళు, ముక్కు, గొంతు మంటగా ఉండటం, తలనొప్పిగా రావటం, వాంతులు రావడం, సృహ తప్పడం, లేదా కోమాలోకి వెళ్ళడం వంటి దుష్ఫలితాలు కలుగును.మరి ఎక్కువగా గురైనచో కాలేయం, మూత్రపిండాలు, కేంద్ర నాడీవ్యవస్థ పాడై, దెబ్బతినును.జంతువులలో అయినచో ఊపిరి తిత్తులు, కాలేయం, థైరాయిడ్, ప్లీహం లమీదప్రభావం చూపిస్తుంది
మూలాలు
[మార్చు]- ↑ "NIOSH Guide—Hydrazine". Centers for Disease Control. Retrieved 16 Aug 2012.
- ↑ 2.0 2.1 "hydrazine—PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 NIOSH Pocket Guide to Chemical Hazards. "#0329". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Hall HK, et al. (1957). "Correlation of the Base Strengths of Amines1". J. Am. Chem. Soc. 79 (20): 5441. doi:10.1021/ja01577a030.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Martel B, Cassidy K, et al. (2004). Chemical Risk Analysis: A Practical Handbook. Amsterdam: Butterworth–Heinemann. p. 361. ISBN 9781903996652. OCLC 939257974.
- ↑ "Hydrazine". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).