హంటింగ్టన్ వ్యాధి
| హంటింగ్టన్ వ్యాధి Huntington's disease | |
|---|---|
| Other names | హంటింగ్టన్ కోరియా, HD[1] |
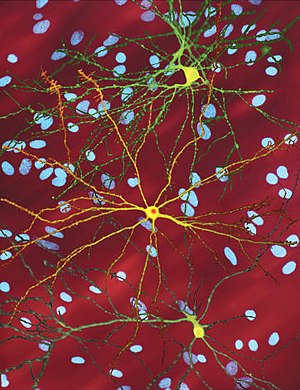 | |
| ఈ వ్యాధి ఏర్పడ్డ పరిస్థితిని ఈ సూక్ష్మ దర్శని చిత్రం సూచిస్తోంది. పసుపు రంగులో అనేక నాడీ తంత్రులు, నారింజ రంగు లో పదార్ధాలు కనపడుతాయి. (image width 360 µm) | |
| Specialty | నాడీ వ్యవస్థ |
| Symptoms | అస్థిర చలనాలు, కండరాలు, నాడులకు, మానసిక సమస్యలు |
| Usual onset | 30–50 years old |
| Duration | జీవితాంతం |
| Causes | జన్యువు (అనువంశికంగా, లేదా కొత్త ఉత్పరివర్తనం) |
| Risk factors | అస్థిర కదలికలు, క్రింద పడిపోవడం, న్యూమోనియా, ఆహారం తీసుకోలేని పరిస్థితి, గుండె జబ్బులు, ఆత్మహత్య ఆలోచన |
| Diagnostic method | జన్యు పరీక్ష |
| Treatment | మద్దత్తు, సంరక్షణ,ఔషదాలు,వ్యాయామం, భౌతిక చికిత్స |
| Medication | టెట్రాబెనజైన్ |
| Prognosis | లక్షణాలు కనపడ్డ 15–20 సంవత్సరాలు |
హంటింగ్టన్ వ్యాధి (Huntington Disease),ని హంటింగ్టన్ కొరియా (Huntington Korea) అని కూడా పిలుస్తారు. ఇది నాడీ వ్యవస్థకు సంబంధించిన వ్యాధి (న్యూరోడెజెనరేటివ్ డిజార్డర్).[2] దీనిలో కొరియా, డిస్టోనియా, భావోద్వేగ ఆటంకాలు, జ్ఞాపకశక్తి, బరువు తగ్గడం, అస్థిర కదలికల వంటి లక్షణాలు కనపడుతాయి. ఇది ఎక్కువగా వారసత్వంగా సంక్రమిస్తుంది. ఐరోపా సంతతికి చెందిన లక్షకు 4 నుండి 15 మందిని HD ప్రభావితం చేస్తుంది. జపనీయులలో ఇది చాలా అరుదు. ఈ వ్యాధి పురుషులు, స్త్రీలను సమానంగా ప్రభావితం చేస్తుంది.[3]
సంకేతాలు, లక్షణాలు[మార్చు]
నిర్దిష్ట లక్షణాలు వ్యక్తులను అనుసరించి కొంతవరకు మారుతూ ఉంటాయి. ఈ వ్యాధి ముందు తరంలో అభివృద్ధి చెందుతుంది. ఈ వ్యాధి లక్షణాలు సాధారణంగా 30 - 50 సంవత్సరాల వయస్సు మధ్య ప్రారంభమవుతాయి.[1] అయితే 8 శాతం సంఘటనలు (కేసులు) 20 సంవత్సరాల వయస్సు లోపల మొదలవుతాయి. దీనిని బాల్య (జువెనైల్ )HD అని పిలుస్తారు. హంటింగ్టన్ వ్యాధి సంకేతాలను, అస్థిర కదలికలు (మోటారు), మేధోపరం లేదా అభిజ్ఞ (కాగ్నిటివ్), మానసిక లక్షణాల త్రయం అంటారు.[1] 50% కేసులలో మానసిక లక్షణాలు మొదట కనిపిస్తాయి.[4] వాటి పురోగతి ప్రారంభ మధ్య దశల్లో, ప్రోడ్రోమల్ దశ (అంటే వ్యాధి మొదలవుతోందనే ఆరంభ సంకేతాలు)తో చివరి దశల్లో కనబడుతుంది. ప్రారంభ, పురోగతి, అభిజ్ఞా ప్రవర్తన లక్షణాలు వ్యక్తుల మధ్య గణనీయంగా మారుతూ ఉంటాయి.[5][6]
ప్రారంభ దశల్లో వ్యక్తిత్వంలో సూక్ష్మమార్పులు అంటే జ్ఞానసముపార్జన, శారీరక సమస్యలు, చిరాకు, మానసిక కల్లోలాలు సంభవిస్తాయి. వ్యాధిని ఈ దశలో గుర్తించలేరు. శారీరక లక్షణాలలో అనియంత్రిత కదలికలు, కుదుపు, అసాధారణ అసంకల్పిత యాదృచ్ఛిక కదలికలు కనపడతాయి.[7]
రుగ్మత పెరిగే కొద్దీ అసాధారణ కదలికలు, అసాధారణ భంగిమ వంటి స్పష్టమైన లక్షణాలు కనపడతాయి. ఈ సంకేతాలు మెదడులోని కదలికకు కారణమైన వ్యవస్థ ప్రభావితమైందని తెలుసుకోవడానికి సహాయపడతాయి. కండరాల నియంత్రణ మరింత బలహీనపడుతుంది. ఈ పరిస్థితిని డిస్టోనియా అని అంటారు. డిస్టోనియా అనేది నరాల విపరీతమైన కదలికల (హైపర్ కైనెటిక్) రుగ్మత. ఇది పునరావృత (రిపీట్) కదలికలకు దారితీస్తుంది. ఫలితంగా శారీరక అస్థిరత, అసాధారణ ముఖ కవళికలు, నమలడం, మాట్లాడటంలో ఇబ్బందులు, నిద్రకు, తినడంలో ఇబ్బందులు, బరువు తగ్గడం వంటి లక్షణాలు పెరిగి పోషకాహార లోపానికి దారితీస్థాయి.[8] సాధారణ సమన్వయ లోపం (Ataxia) అస్థిరమైన నడక కనిపిస్తాయి. ఇది కొరియా వ్యాధి ( Chorea) అని పిలువబడే అతిగా చలించే కదలికలు ఉన్న రుగ్మత (హైపర్ కైనెటిక్ మూవ్మెంట్ డిజార్డర్) కు కారణమయ్యే మెదడులోని బేసల్ గాంగ్లియా వ్యాధి. వ్యాధి అభివృద్ధి చెందుతున్నప్పుడు సమన్వయం కష్టమయి వ్యక్తి మాట్లాడలేనంతగా శారీరక సామర్థ్యాలు క్షీణిస్తాయి.[9]
బాల్య HD అభిజ్ఞా క్షీణతతో వేగవంతంగా అభివృద్ధి చెందుతుంది, గట్టిగా వంగలేకుండా ఉండి, మూర్ఛలు వంటి ప్రకంపనలతో కొరియా వ్యాధి లక్షణాలు కనపడతాయి.[10]
అభిజ్ఞా (కాగ్నిటివ్) సామర్థ్యాలు క్రమంగా బలహీనపడి చిత్తభ్రంశం (డెమెన్షియా) వ్యాధిని పోలిన లక్షణాలు కనిపిస్తాయి.[11] కార్యనిర్వాహక విధులైన - ప్రణాళిక, అభిజ్ఞా అనుకూలత, నైరూప్య ఆలోచన, నియమ సముపార్జన, తగిన చర్యలను ప్రారంభించడం, అనుచిత చర్యలను నిరోధించడం వంటివి ప్రభావితం అవుతాయి. దీనితో పనులపై దృష్టి పెట్టడం, వశ్యత (flexibility) లేకపోవడం, ప్రేరణ పొందలేక పోవడం, తమ ప్రవర్తన, సామర్ధ్యాలపై అవగాహన లేకపోవడం, కొత్తవిషయాలు నేర్చుకోవడం, అమలు చేయడంలో ఇబ్బంది వంటి సమస్యలు ఎదుర్కుంటూ ఉంటారు. వ్యాధి పెరిగే కొద్దీ జ్ఞాపకశక్తి తగ్గుతూంటుంది.[12]
నాడీ వ్యవస్థకు సంబంధించిన మానసిక (న్యూరోసైకియాట్రిక్) రుగ్మతల సంకేతాలైన ఆందోళన, నిరాశ, భావోద్వేగాల ప్రదర్శన తగ్గడము, అహంభావం, దూకుడు, నిర్బంధ ప్రవర్తన, వ్యసనాలు కనపడుతాయి.ఇంకా అబ్సెసివ్ కంపల్సివ్ డిజార్డర్, వ్యామోహం (మానియా), నిద్రలేమి (ఇన్సోమ్నియా), బైపోలార్ డిజార్డర్లు, ఇతరుల ప్రతికూల వ్యక్తీకరణలను గుర్తించడం వంటి ఇబ్బందులు ఉంటాయి. HD ప్రవర్తనా మార్పులు ఆత్మహత్య ప్రమాదాన్ని పెంచుతాయి.[7]
హంటింగ్టిన్ ఉత్పరివర్తన ఉనికి శరీరం అంతటా, మెదడు అసాధారణతలతో తెలుస్తుంటుంది. అవి - కండరాల క్షీణత, గుండె వైఫల్యం, బలహీనమైన గ్లూకోజ్ సహనం, బరువు తగ్గడం, బోలు ఎముకల వ్యాధి (ఆస్టియోపొరోసిస్), వృషణాల క్షీణత మొదలైనవి.[13]
జన్యు కారణాలు[మార్చు]
అనేక ట్రైన్యూక్లియోటైడ్ పునరావృత (ట్రైన్యూక్లియోటైడ్ రిపీట్ ఎక్స్పాన్షన్) రుగ్మతలలో HD ఒకటి. ప్రతి ఒక్కరికి హంటింగ్టిన్ జన్యువు (HTT) కి రెండు నకళ్ళుంటాయి. ఇది హంటింగ్టిన్కు ప్రోటీన్ (Httt) సంకేత భాష (కోడ్) ఏర్పరుస్తుంది. HTTని HD జన్యువు(జీన్) లేదా IT15 జీన్ అని కూడా పిలుస్తారు.
HD సాధారణంగా హంటింగ్టిన్ జన్యువు (HTT) ఉత్పరివర్తనము (మ్యుటేషన్)ను కలిగి ఉన్న బాధిత తల్లిదండ్రుల నుండి వారసత్వంగా రావడము వలన కలుగుతుంది.[1] అయితే 10% మందిలో కొత్త ఉత్పరివర్తనము (మ్యుటేషన్) వలన కూడా సంభవిస్తుంది. హంటింగ్టిన్ జన్యువు హంటింగ్టిన్ ప్రోటీన్ (Htt) కు జన్యు సమాచారాన్ని అందిస్తుంది. HTT మూడు DNA స్థావరాల క్రమాన్ని కలిగి ఉంటుంది: సైటోసిన్, అడెనైన్, గ్వానిన్ (CAG) అనేది మూడు అక్షరాల జన్యు సంకేతం (అమైనో ఆమ్లం గ్లూటామైన్ కోడ్). ఇది అనేక సార్లు పునరావృతాన్ని (అనగా. ...... CAGCAGCAG....ను ట్రైన్యూక్లియోటైడ్ రిపీట్ అని పిలుస్తారు. ఇది వ్యక్తుల మధ్య తరాల మధ్య కూడా వ్యవధి మారుతూ ఉంటుంది. డైనమిక్ మ్యుటేషన్ పునరావృత సంఖ్యను పెంచి మరింత లోపభూయిష్ట జన్యువుకు దారితీయవచ్చు. ఒక నిర్దిష్ట పరిమితికి చేరుకున్నప్పుడు, ఇది ఉత్పరివర్తన హంటింగ్టిన్ ప్రోటీన్ (mHttt) మార్పు చెందిన రూపాన్ని ఉత్పత్తి చేస్తుంది. ఈ ప్రోటీన్ల విభిన్న లక్షణాలు లేదా విధులు రోగలక్షణ మార్పులకు, వ్యాధి పురోగతికి కారణం. CAG పునరావృతాల విస్తరణ అసాధారణమైన ఉత్పరివర్తన ప్రోటీన్ (mHtt)కి దారితీస్తుంది. ఈ పరిస్థితి క్రమంగా మెదడు కణాలను దెబ్బతీస్తుంది.[3] జన్యు పునరావృత గమనం, దాని తీవ్రత తల్లిదండ్రుల లింగం ద్వారా ప్రభావితమవుతుంది. సాధారణంగా CAG పునరావృత్తుల సంఖ్య లక్షణాలు ప్రారంభమైన వయస్సు ప్రభావము 60% వరకు ఉంటుంది. మిగిలినది పర్యావరణం, HD యంత్రాంగాన్ని సవరించే ఇతర జన్యువులకు సంబంధించి ఉంటుంది.[14]

హంటింగ్టన్ వ్యాధికి ప్రభావితమైన వ్యక్తి విస్తరించిన ట్రైన్యూక్లియోటైడ్ రిపీట్ (ఉత్పరివర్తన అల్లెలే అంటే జంట జన్యువులలో ఒకటి) తో జన్యువు ఒక నకలుని వారసత్వంగా పొందుతే ప్రభావిత వ్యక్తి సంతానానికి చిత్రంలో చూపినట్లు 50% ప్రమాదం ఉంటుంది[15]. తల్లిదండ్రులిద్దరికీ HD జన్యువు విస్తరించి ఉన్న అరుదైన పరిస్థితులలో ప్రమాదం 75%కి పెరుగుతుంది. చాలా అరుదుగా తల్లిదండ్రులలో ఇద్దరికి రెండు విస్తరించిన నకలులు ఉన్నప్పుడు 100% ప్రమాదం ఉంటుంది. అందరు పిల్లలు ప్రభావితమవుతారు.[16][17] హంటింగ్టన్ వ్యాధి అరుదుగా కొత్త మ్యుటేషన్ వల్ల సంభవిస్తుంది.[18] ఏదేని సందర్భంలో పిల్లలలో ఎవరికైనా ఈ వ్యాధి రాకపోతే ఈ పరంపర ఆగిపోయి తరువాత తరాలు వ్యాధి నుండి ముక్తి పొందుతాయి.[2][3]
| పునరావృతం
లెక్కింపు |
వర్గీకరణ | వ్యాధి స్థితి | సంతానానికి
ప్రమాదం |
|---|---|---|---|
| < 27 | సాధారణం | ప్రభావితం కాదు | ఏమీ లేదు. |
| 27 - 35 | మధ్యంతరం | ప్రభావితం కాదు | ఉంటుంది,
కానీ 50% లోపు |
| 36 - 39 | తగ్గిన ప్రవేశం | ప్రభావం ఉండచ్చు
లేదా లేకపోవచ్చు |
50% |
| 40+ | పూర్తిగా చొచ్చు
కొచ్చే విధానం |
ప్రభావం ఉంటుంది | 50% |



రోగ నిర్ధారణ[మార్చు]
కుటుంబ చరిత్రలో HD లేనట్లయితే వ్యాధికి ప్రత్యేకమైన శారీరక లక్షణాలు కనిపించిన తరువాత రోగనిర్ధారణ కోసం జన్యు పరీక్ష నిర్వహించవచ్చు. కుటుంబంలో లక్షణాలు ఉంటే ప్రారంభానికి ముందే లేదా పిండం దశలో కూడా వ్యాధిని కలిగించే HTT జన్యువులో ట్రైన్యూక్లియోటైడ్ రిపీట్ (CAG) విస్తరించిన నకలును గుర్తించడానికి జన్యు పరీక్ష చేస్తారు. జన్యు పరీక్ష ప్రక్రియకు సంబంధించిన సలహా, మార్గదర్శకత్వం అందించడానికి సంప్రదింపుల సమావేశం (జన్యు కౌన్సెలింగ్) జరుపుతారు. కొన్నిసార్లు శారీరక పరీక్షతో పాటు మానసిక పరీక్ష ద్వారా కూడా వ్యాధి ప్రారంభమైందో లేదో నిర్ణయిస్తారు. సిటి స్కాన్, ఎంఆర్ఐ స్కాన్ వంటి మెడికల్ ఇమేజింగ్ పరికరాలద్వారా వ్యాధి ప్రారంభంలో కాడేట్ న్యూక్లియస్ క్షీణతను చూపించగలదు. వ్యాధి పురోగమించిన దశలలో మస్తిష్క క్షీణతను కనపడుతుంది. ఫంక్షనల్ మాగ్నెటిక్ రెసొనెన్స్ ఇమేజింగ్ (FMRI), పాజిట్రాన్ ఎమిషన్ టోమోగ్రఫీ (PET) వంటి ఫంక్షనల్ న్యూరోఇమేజింగ్ పద్ధతులు శారీరక లక్షణాలు ప్రారంభమయ్యే ముందు మెదడులో మార్పులను చూపగలవు.[14]

వ్యాధి పురోగతిని ఏకీకృత హంటింగ్టన్ వ్యాధి రేటింగ్ స్కేల్ ఉపయోగించి కొలుస్తారు. ఇది వ్యాధిగ్రస్తుని కదలికలు, ప్రవర్తన, అభిజ్ఞా, క్రియాత్మక మదింపుల ఆధారంగా మొత్తం రేటింగ్ అందిస్తుంది.[20][21]
HD జన్యు పరీక్షలలో రక్త పరీక్ష ఉంటుంది. ఇది ప్రతి HTT యుగ్మ వికల్పాలలో CAG పునరావృతాల సంఖ్యను (పట్టిక) లెక్కిస్తుంది.[22]
- 40 లేదా ఎక్కువ CAG పూర్తి చొచ్చుకుపోయే యుగ్మవికల్పం (FPA) పునరావృతం చేస్తుంది.[23] ఈ ఫలితం రోగ నిర్ధారణ చేయదు కానీ, వ్యాధిని సూచిస్తుంది. అనువంశికంగా 50% వ్యాధి పొందే అవకాశము ఉన్న వ్యక్తికి ప్రమాదం ఉందా లేదా అని నిర్ణయిస్తుంది.[14]
- 36 నుండి 39 పునరావృత్తులు, అసంపూర్ణమైన లేదా తగ్గిన చొచ్చుకుపోయే యుగ్మవికల్పం (RPA) ను సూచిస్తుంది. గరిష్ఠ ప్రమాదం 60%. RPA తో ఉన్న వ్యక్తులకు చాలావరకు (అంటే 75%) వయోజన జీవితంలో 65 సంవత్సరాల వయస్సు వద్ద రోగలక్షణంగా కనపడుతుంది.
- 27 నుండి 35 వరకు పునరావృతమయ్యే ఇంటర్మీడియట్ యుగ్మవికల్పం (IA) వ్యక్తికి వ్యాధితో సంబంధం ఉండదు, కానీ తరువాత తరాలకు వారసత్వంగా విస్తరించవచ్చు.
- 26 లేదా అంతకంటే తక్కువ పునరావృత్తులు ఉంటే, HDతో సంబంధం ఉండదు.[23]
ఈ వ్యాధికి చికిత్స లేదు కాబట్టి 95% పైగా వారసత్వంగా HD వచ్చే ప్రమాదం ఉన్న వ్యక్తులు ఆందోళన వలన పరీక్ష చేసుకోరు. పరీక్ష ఫలితం సానుకూలం అయితే ఆత్మహత్య ప్రమాదం పెరుగుతుంది.[14] HD ఉన్నవారిలో రోగ నిర్ధారణ జరగడానికి ముందు, తరువాతి దశలను నివారించాలనే కోరికతో వ్యాధి ముదిరే దశలలో 7.3% మంది తమ ప్రాణాలను తీసుకుంటున్నారు, 27% వరకు ఆత్మహత్యలు చేసుకోవడానికి ప్రయత్నిస్తున్నారు.[24][25]
ఇన్ విట్రో ఫలదీకరణాన్ని ఉపయోగించి ఉత్పత్తి చేయబడిన పిండాలను ప్రీ ఇంప్లాంటేషన్ జన్యు నిర్ధారణను ఉపయోగించి HD కోసం జన్యుపరంగా పరీక్షించవచ్చు.[26][27] ఇందులో గర్భం రద్దు చేయడం కానీ, లేదా గుర్తించిన జన్యువుతో ఉన్న పిల్లల ఇబ్బందులపై కౌన్సిలింగ్ చేయవచ్చు.[28]
చికిత్స, నిర్వహణ[మార్చు]

HD ఉన్నవారిలో కదలికలను సమన్వయ పరిచే సామర్థ్యం క్షీణించడంతో, ఊపిరితిత్తులు స్వచ్ఛంగా గాలి తీసుకోవడంలో ఇబ్బంది, ఆహారం లేదా పానీయం తీసుకోలేకపోవడం న్యుమోనియా, గుండె జబ్బులు సంక్రమించే ప్రమాదం ఉంటుంది. HDకి చికిత్స లేదు కానీ తరువాతి దశలలో లక్షణాల తీవ్రతను తగ్గించడానికి చికిత్సలు అందుబాటులో ఉన్నాయి. వ్యాధి పెరిగే కొద్దీ తనను తాను చూసుకోగల సామర్థ్యం తగ్గుతుంది కాబట్టి ఉపశమనం కోసం, జీవన నాణ్యతను మెరుగుపరచడము కోసం బహుళ విభాగ సంరక్షణ అవసరం అవుతుంది. సాధారణంగా వ్యాధిని మొదట గుర్తించినప్పటి నుండి 15-20 సంవత్సరాలలో మరణం సంభవిస్తుంది. సుమారు 9% కేసుల్లో ఆత్మహత్యే మరణానికి కారణం.[1]
హంటింగ్టన్ వ్యాధి ఉన్న వ్యక్తులకు శారీరకంగా బలోపేతం చేయడానికి భౌతికంగా వ్యాయామాలను నిర్వహించడానికి, దీర్ఘకాలిక స్వతంత్ర నిర్వహణ కోసం భౌతిక చికిత్సకుడి సహాయము తీసుకోవచ్చు. వ్యాయామాలు అభిజ్ఞా లక్షణాలను పునరావాసానికి సహాయపడతాయని అధ్యయనాలు చూచూపిస్తున్నాయి. భౌతిక చికిత్స - వృత్తిపరమైన ప్రసంగ చికిత్స (speech therapy) కూడా ఉపయోగపడుతాయి. రోగికి, కుటుంబ సభ్యులకు, సంరక్షకులకు హంటింగ్టన్ వ్యాధి గురించి అవగాహనా కార్యక్రమం రూపొందింస్తారు.[29]
హంటింగ్టన్ వ్యాధిలో ఏర్పడే వివిధ లక్షణాలను అనుసరించి వాటి ఉపశమనం కొరకు ఔషదాలు వాడుతారు. కదలిక సమస్యల చికిత్సకు టెట్రాబెనజైన్ పనిచేస్తుందని అంటారు. కొరియా వ్యాధికి టెట్రాబెనాజిన్ (2000లో యూరోపియన్ యూనియన్లో 2008లో USలో ఆమోదించబడింది, FDA ఆమోదించింది.[30] దీనిని ఆస్టెడో అని విక్రయిస్తారు.).[31] ప్రత్యామ్నాయంగా అమంటాడిన్ వాడతారు. ఇతర మందులలో యాంటిసైకోటిక్స్, బెంజోడియాజిపైన్స్ [32] బాల్య కేసులలో యాంటిపార్కిన్సోనియన్ మందులు, మయోక్లోనిక్ హైపర్కినేసియాను వాల్ప్రోయిక్ ఆమ్లంతో చికిత్స చేస్తారు.[32]
డైస్ఫాగియా (ఆహారం తినడంలో ఇబ్బంది), బరువు తగ్గడం వలన పోషకాహార నిర్వహణ ముఖ్యం. అందుకని పర్క్యుటేనియస్ ఎండోస్కోపిక్ గ్యాస్ట్రోస్టోమీ (కడుపులోకి జతచేయబడిన ఆహారం నాళం) ప్రక్రియ వలన మెరుగైన పోషక నిర్వహణను అందించవచ్చు.[33]

మానసిక లక్షణాలకు సాధారణ మందుల మాదిరిగానే చికిత్స చేయవచ్చు. డిప్రెషన్ కోసం సెలెక్టివ్ సెరోటోనిన్ రీఅప్టేక్ ఇన్హిబిటర్స్, మిర్టాజాపైన్; సైకోసిస్, ప్రవర్తనా సమస్యలకు వైవిధ్యమైన యాంటిసైకోటిక్స్ సిఫార్సు చేస్తారు.[34] ప్రజలకు బహుళ మందులతో కలిపి దీర్ఘకాలిక చికిత్స అవసరం కావచ్చు కాబట్టి న్యూరో సైకాట్రిక్ నిపుణుల సూచనలు తీసుకుంటారు. మెదడులోని ప్రభావిత ప్రాంతాలలో మూలకణాలను మార్పిడి చేయడం ద్వారా దెబ్బతిన్న న్యూరాన్లను భర్తీ చేయడానికి మూలకణ చికిత్సను ఉపయోగిస్తారు.[35]
2020 నాటికి హంటింగ్టన్ వ్యాధి కోసం వివిధ చికిత్సలు వైద్యానికి సంబంధించిన ప్రయత్నాలు కొనసాగుతున్నవి.[36] హంటింగ్టన్ వ్యాధి పురోగతిని నిరోధించడం లేదా మందగించడం కొరకు రెమాసెమైడ్ (remacemide) కోఎంజైమ్ Q10′ రిలూజోల్ (riluzole′) క్రియేటిన్ ′ మినోసైక్లిన్ (minocycline)′ ఇథైల్ - EPA′ ఫినైలబ్యూటైరేట్ (phenylbutyrate) డైమ్బాన్ (dimebon)మొదలగునవి ఉప్రయోగిస్తున్నారు.[37]
ఇవి కాకుండా ఆయుర్వేద వైద్య విధానంలో వృక్ష జాతుల ఉత్పత్తులతో ప్రత్యామ్నాయ చికిత్సలు, ప్రయోగాలు అనేకం జరుగుతున్నాయి. ఆమ్లా(ఉసిరి) రసాయనం, రస-సిందూర్ ల మిశ్రమం హంటింగ్టన్, అల్జీమర్స్ వ్యాధుల న్యూరో డిజెనరేషన్ను అణిచివేస్తాయి.[38][39]. HD లక్షణాలను అణచివేసే, పురోగతిని నిరోధించే అనేక ప్రకృతి సహజంగా లభించే వనరులు - మూలికలు, ఆకులు, వేర్లు మొదలైనవాటి ఉపయోగాలు కనుగొన్నారు. వాటిలో కొన్ని - [40]
- బాకోపా మొన్నీరి (BM) లేదా హెర్పెస్టిస్ మొన్నీరా. సాధారణంగా బ్రాహ్మి అని పిలుస్తారు
- విధానియా సోమ్నిఫెరా (WS), సాధారణంగా అశ్వగంధ అని పిలుస్తారు
- కర్కుమా లాంగా (CL). దీనిని పసుపు అని పిలుస్తారు
- సెసమ్ ఇండికమ్ లిన్. సాధారణంగా నువ్వులు (తిల్) అని పిలుస్తారు, ఇది భారతదేశం ఇతర తూర్పు ఆసియా దేశాలలో ఆరోగ్య కరమైన ఆహారంగా పరిగణిస్తారు.
- జింగో బిలోబా L. 5,000 సంవత్సరాల క్రితం చైనీస్ మెటీరియా మెడికాలో ప్రస్తావించబడింది.
- జిన్సెంగ్ రూట్ ఒక ప్రసిద్ధ మూలికా ఔషధం. సెంటెల్లా ఆసియాటికా (CA). సాధారణంగా గోటు కోలా అని పిలుస్తారు
- ఫ్లేవనాయిడ్స్ అనేది మొక్కల నుంచి లభించే పాలీఫెనోలిక్ సమ్మేళనాల సమూహం
- లైకోపీన్ కెరోటినాయిడ్. ఇది టమోటాలు ఆధారిత ఉత్పత్తులలో లభిస్తుంది.
చరిత్ర[మార్చు]

1842లో రాబ్లీ డంగ్లిసన్ "ప్రాక్టీస్ ఆఫ్ మెడిసిన్" మొదటి సంచికలో చార్లెస్ ఆస్కార్ వాటర్స్ (1816 - 1892) ఈ వ్యాధి గురించి రాసిన ఒక లేఖ ప్రచురించారు.[42] 1846లో చార్లెస్ రోలిన్ గోర్మన్ (1817 - 1879) స్థానిక ప్రాంతాలలో వ్యాధి అధిక ప్రాబల్యం ఎలా సంభవిస్తుందో గమనించారు.[43][44] గోర్మన్, వాటర్స్, ఫిలడెల్ఫియాలోని జెఫెర్సన్ వైద్య కళాశాలలో డంగ్లిసన్ ఇద్దరు విద్యార్థులు జోహన్ క్రిస్టియన్ లండ్ (1830 - 1906) కూడా 1860లో ఒక ప్రారంభ వివరణను అందించారు.[44][45]. నార్వేలోని ఒక పర్వత లోయలో ఉన్న సెటెస్డేలెన్లో (Setesdalen) చిత్తవైకల్యం, ఎక్కువ కుదుపు కదలికల రుగ్మతలతో నడిచే కుటుంబాలను ఆతను ప్రత్యేకంగా గుర్తించాడు.[46] మెండెలియన్ అనువంశిక సూత్రాలు కనుగొనడానికి కొన్ని సంవత్సరాల ముందు1872లో జార్జ్ హంటింగ్టన్ అను ఒహియో దేశ వైద్యుడు ఈ వ్యాధి వారసత్వం గురించి మొట్టమొదటి సమగ్ర వివరణ ఇచ్చారు. 19వ శతాబ్దం చివరినాటికి చాలా దేశాలు ఈ వ్యాధిని ప్రపంచమంతా విస్తరించినట్లుగా గుర్తించాయి.
వ్యాధి ప్రాబల్యం[మార్చు]

వంశపారంపర్య వ్యాధి ఫౌండేషన్ (Hereditary Disease Foundation) నేతృత్వంలో అంతర్జాతీయ సహకార సంస్థలు 1993లో ఈ వ్యాధికి జన్యుపరమైన ఆధారం కనుగొన్నారు. పరిశోధనలకు సహాయపడే జంతు నమూనాలను మెరుగుపరచడం, మందులను పరీక్షించడం, వ్యాధి లక్షణాలకు చికిత్స చేయడానికి లేదా వ్యాధి పురోగతిని నెమ్మదింపజేయడం, దెబ్బతిన్న నాడులకు (న్యూరాన్లకు) మూలకణాల చికిత్సా (స్టెమ్-సెల్ థెరపీ) విధానాలను అనుసరించడం, అధ్యయనం చేయడం వంటివి ఉన్నాయి.[47] 1960ల చివరలో ప్రజలలో అవగాహనను పెంపొందించడానికి, రోగుల కుటుంబాలకు మద్దతును అందించడానికి పరిశోధనను ప్రోత్సహించడానికి సహాయ సమూహాలు పరిశోధన చేయడం ప్రారంభించాయి.[48][49]
ఈ వ్యాధి నిర్ధారణ పరీక్షలకు, ప్రయోగాలకు జంతువులను ఉపయోగించడంలోను, వ్యాధిగ్రస్తుల వలసల నియంత్రణకు, మూలకణాల వినియోగంలో, పిండదశలో రోగనిర్ధారణ తదుపరి అనుసరించవలిసిన పద్ధతులలోను సామాజికంగా, నైతికంగా అనేక సవాళ్లు ఎదుర్కొన్నారు.[50][51][52]
ప్రపంచవ్యాప్తంగా 100,000 మందికి 5 -10 వరకు HD కేసులు ఉన్నాయి, అయితే స్థానిక వలసలు ఫలితంగా భౌగోళిక వైవిధ్యం ఉంటుంది.[53][54] పశ్చిమ ఐరోపాలో ఈ వ్యాధి సంభవించే రేటు అత్యధికంగా ఉంది - సగటున 100,000 మందికి ఏడుగురు ఉన్నారు, ఆసియా, ఆఫ్రికన్ సంతతికి చెందిన మిలియన్ల మందికి ఒకరు ఉన్నారు. 1990 - 2010 మధ్య UKలో హంటింగ్టన్ వ్యాధి ప్రాబల్యం గురించి 2013 ఎపిడెమియోలాజికల్ అధ్యయనం UKలో ప్రాబల్యం 100,000కు 12.3గా ఉందని కనుగొన్నారు. వెనిజులాలోని మరాకైబో సరస్సు ప్రాంతంలో 100,000 మందికి 700 HD ప్రభావానికి గురైయ్యారు. టాస్మానియా, స్కాట్లాండ్, వేల్స్, స్వీడన్లోని నిర్దిష్ట ప్రాంతాలలోను అధిక స్థానికీకరణ ఉన్న ఇతర ప్రాంతాలలో వ్యాధి ప్రాబల్యం ఎక్కువ ఉంది.[25] ఐస్ల్యాండ్ ప్రాబల్యం 100,000 కు 1 గా ఉంది. ఫిన్లాండ్లో 100,000 మందికి 2.2 కంటే తక్కువ కేసులు ఉన్నాయి.
సహాయక సంస్థలు[మార్చు]
1968లో, తన భార్య కుటుంబంలో HD ఉండడముతో, డాక్టర్ 'మిల్టన్ వెక్స్లర్' జన్యు అనారోగ్యాలను నయం చేసే లక్ష్యంతో పరిశోధనలకు మద్దతు సమన్వయం చేయడం కోసం వంశపారంపర్య వ్యాధి ఫౌండేషన్ను (HDF) ప్రారంభించాడు. వెనెజులాలో ఈ.పరిశోధనా బృందంలో వెక్స్లర్ కుమార్తె 'నాన్సీ వెక్స్లర్' కీలక వ్యక్తి.[48]
దాదాపుగా అదే సమయంలో 'మార్జోరీ గుత్రీ' (Marjorie Guthrie), తన భర్త జానపద గాయకుడు - గేయరచయిత 'వుడీ గుత్రీ' HD సమస్యలతో మరణించిన తరువాత హంటింగ్టన్ డిసీజ్ (ప్రస్తుతం హంటింగ్టన్ డిసీజ్ సొసైటీ ఆఫ్ అమెరికా) కమిటీని ఏర్పాటుచేయడంలో సహాయపడింది.[49]
అప్పటి నుండి ప్రపంచంలోని అనేక దేశాలలో HD మద్దతు పరిశోధనా సంస్థలు ప్రజలలో అవగాహన పెంచడానికి సహాయపడ్డాయి. వీటిలో ముఖ్యమైనవి - ఇంటర్నేషనల్ హంటింగ్టన్ అసోసియేషన్; యూరోపియన్ హెచ్డి నెట్వర్క్ వంటి సంస్థలు. వీటిలో కొన్నింటికి ఆయా ప్రభుత్వాలు ఆమోదం తెలిపాయి. ఉదాహరణకు జూన్ 6వ తేదీని యూఎస్ సెనేట్ (US Senete) "నేషనల్ హంటింగ్టన్ డిసీజ్ అవగాహనా దినం"గా ప్రకటించింది.[55] UK లో క్యూర్ హంటింగ్టన్ డిసీజ్ ఇనిషియేటివ్ ఫౌండేషన్ (CHDI) పరిశోధనకు అతిపెద్ద నిధులను అందిస్తుంది.[56]
యూరోపియన్ మాలిక్యులర్ జెనెటిక్స్ క్వాలిటీ నెట్వర్క్ ఈ వ్యాధికి మాలిక్యులర్ జెనిటిక్ టెస్టింగ్ కోసం వార్షిక బాహ్య నాణ్యత అంచనా పథకాన్ని ప్రచురించింది. HD పరీక్ష ఫలితాలు నివేదించడంలో సహాయపడటానికి, జన్యు పరీక్ష కోసం ఉత్తమ అభ్యాస మార్గదర్శకాలను అభివృద్ధి చేసింది.[57]
ఆసియా ఖండంలో - హంటింగ్టన్'స్ డిసీజ్ యూత్ ఆర్గనైజేషన్, చైనీస్ HD అసోసియేషన్ Archived 2023-06-25 at the Wayback Machine; ఇజ్రాయెల్ హంటింగ్టన్'స్ డిసీజ్ అసోసియేషన్; జపనీస్ హంటింగ్టన్'స్ డిసీజ్ నెట్వర్క్; ఒమన్ హంటింగ్టన్ డిసీజ్ అసోసియేషన్ Archived 2022-03-03 at the Wayback Machine; హంటింగ్టన్ డిసీజ్ కేర్ & క్యూర్ సొసైటీ ఆఫ్ పాకిస్థాన్; ఆర్ఫన్ పీపుల్ (రష్యా); కొరియన్ హంటింగ్టన్'స్ డిసీజ్ సొసైటీ; టర్కీ హంటింగ్టన్ అసోసియేషన్ వంటి సంస్థలు ఇంకా భారతదేశంలో హంటింగ్టన్ డిసీజ్ సొసైటీ ఇండియా HD గురించిన సమాచారం, సహాయము, ఆవగాహన, సంప్రదింపుల సేవలు అందిస్తున్నాయి.
ప్రస్తావనలు[మార్చు]
- ↑ 1.0 1.1 1.2 1.3 1.4 "Huntington's Disease Information Page | National Institute of Neurological Disorders and Stroke". www.ninds.nih.gov. Retrieved 14 December 2020.
- ↑ 2.0 2.1 "Huntington's disease - Treatment and support". 23 October 2017.
- ↑ 3.0 3.1 3.2 "Molecular Pathogenesis in Huntington's Disease". protein.bio.msu.ru. Retrieved 8 November 2020.
- ↑ (March 2018). "[Psychiatric symptoms in patients with Huntington's disease]".
- ↑ Kremer B (2002). "Clinical neurology of Huntington's disease". In Bates G, Harper P, Jones L (eds.). Huntington's Disease – Third Edition. Oxford: Oxford University Press. pp. 28–53. ISBN 978-0-19-851060-4.
- ↑ . "Psychiatric Morbidity in Huntington's disease".
- ↑ 7.0 7.1 Kumar, Abbas A, Aster J (2018). Robbins basic pathology (Tenth ed.). Philadelphia, Pennsylvania: Elsevier. p. 879. ISBN 9780323353175.
- ↑ "Booklet by the Huntington Society of Canada" (PDF). Caregiver's Handbook for Advanced-Stage Huntington Disease. HD Society of Canada. 11 April 2007. Archived from the original (PDF) on 25 June 2008. Retrieved 10 August 2008.
- ↑ Purves D (2012). Neuroscience (5th ed.). Sunderland, Mass. p. 415. ISBN 9780878936953.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ Dickey AS, La Spada AR (April 2018). "Therapy development in Huntington disease: From current strategies to emerging opportunities". American Journal of Medical Genetics. Part A. 176 (4): 842–861. doi:10.1002/ajmg.a.38494.
- ↑ Frank S (January 2014). "Treatment of Huntington's disease". Neurotherapeutics. 11 (1): 153–160. doi:10.1007/s13311-013-0244-z.
- ↑ Montoya A, Price BH, Menear M, Lepage M (January 2006)."Brain imaging and cognitive dysfunctions in Huntington's disease" (PDF). Journal of Psychiatry & Neuroscience. 31 (1): 21–29. Archived from the original (PDF) on 23 March 2016. Retrieved 17 September 2008.
- ↑ (August 2009). "Beyond the brain: widespread pathology in Huntington's disease".
- ↑ 14.0 14.1 14.2 14.3 14.4 Walker FO (January 2007). "Huntington's disease". Lancet. 369 (9557): 218–228. doi:10.1016/S0140-6736(07)60111-1.
- ↑ Passarge E (2001). Color Atlas of Genetics (2nd ed.). Thieme. p. 142. ISBN 978-0-86577-958-7.
- ↑ . "Homozygotes for Huntington's disease".
- ↑ (April 2003). "Homozygosity for CAG mutation in Huntington disease is associated with a more severe clinical course".
- ↑ (October 2006). "Predictive testing for Huntington disease: interpretation and significance of intermediate alleles".
- ↑ "Huntington's disease". Radiology picture of the day. www.radpod.org. 1 May 2007. Archived from the original on 22 October 2007. Retrieved 24 July 2009.
- ↑ (April 2009). "Clinical measurement of mobility and balance impairments in Huntington's disease: validity and responsiveness".
- ↑ "Unified Huntington's Disease Rating Scale (UHDRS)". UHDRS and Database. HSG. 1 February 2009. Archived from the original on 11 August 2015. Retrieved 14 April 2009.
- ↑ (April 2004). "Huntington's disease genetics".
- ↑ 23.0 23.1 (May 2013). "Reproductive options for prospective parents in families with Huntington's disease: clinical, psychological and ethical reflections". . "Reproductive options for prospective parents in families with Huntington's disease: clinical, psychological and ethical reflections".
- ↑ Crauford D, Snowden J (2002). "Neuropyschological and neuropsychiatric aspects of Huntington's disease". In Bates G, Harper P, Jones L (eds.). Huntington's Disease – Third Edition. Oxford: Oxford University Press. pp. 62–87. ISBN 978-0-19-851060-4.
- ↑ 25.0 25.1 Harper P (2002). "The epidemiology of Huntington's disease". In Bates G, Harper P, Jones L (eds.). Huntington's Disease – Third Edition. Oxford: Oxford University Press. pp. 159–189. ISBN 978-0-19-851060-4.
- ↑ (February 1996). "Preimplantation genetic testing for Huntington disease and certain other dominantly inherited disorders".
- ↑ (June 2002). "Non-disclosing preimplantation genetic diagnosis for Huntington disease".
- ↑ "Guidelines for Genetic Testing for Huntington's Disease". Heredity Disease Foundation. Archived from the original on 26 June 2015. Retrieved 7 May 2013.
- ↑ "EHDN Physiotherapy Guidance Document" (PDF). European HD Network Physiotherapy Working Group. Archived from the original (PDF) on 4 March 2016. Retrieved 2015-11-15.
- ↑ Center for Drug Evaluation Research (17 July 2019). "In Pursuit of Tardive Dyskinesia: The Breakthrough Designation and Approval of Valbenazine". FDA (in ఇంగ్లీష్). Retrieved 15 November 2020.
- ↑ "FDA Approves First Drug for Treatment of Chorea in Huntington's Disease". U.S. Food and Drug Administration. 15 August 2008. Archived from the original on 21 August 2008. Retrieved 10 August 2008.
- ↑ 32.0 32.1 (June 2020). "Huntington Disease". University of Washington.
- ↑ . "DPEJ tube placement prevents aspiration pneumonia in high-risk patients".
- ↑ (March 2004). "Huntington's disease: present treatments and future therapeutic modalities".
- ↑ . "Therapeutic effects of stem cells in rodent models of Huntington's disease: Review and electrophysiological findings".
- ↑ "Search of: Huntington Disease - List Results - ClinicalTrials.gov". clinicaltrials.gov (in ఇంగ్లీష్).
- ↑ "Completed Clinical Trials". Huntington Study Group. Archived from the original on 28 June 2012. Retrieved 4 February 2012.
- ↑ Jayaraman, K.S. (30 December 2013). "Ayurveda for Huntington's and Alzheimer's?". Nature India.
- ↑ Dwivedi, Vibha; Tripathi, Bipin K.; Mutsuddi, Mousumi; Lakhotia, Subhash C. (25 December 2013). "Ayurvedic Amalaki Rasayana and Rasa-Sindoor suppress neurodegeneration in fly models of Huntington's and Alzheimer's diseases". Current Science. 106 (12) – via Researchgate.
- ↑ Choudhary, Sunayna; Kumar,, Puneet; Malik, Jai (July–December 2013). "Plants and phytochemicals for Huntington's disease". Pharmacognosy Review. 7 (14): 81–91. doi:10.4103/0973-7847.120505 – via NIH/National library of medicine.
{{cite journal}}: CS1 maint: date format (link) CS1 maint: extra punctuation (link) CS1 maint: unflagged free DOI (link) - ↑ . "On Chorea".
- ↑ Dunglison R (1842). The Practice of Medicine ... Vol. 2. Philadelphia, Pennsylvania, USA: Lea & Blanchard. pp. 312–313.
- ↑ Gorman, Charles R. (1846) Thesis for the degree Doctor of Medicine: "On a Form of Chorea, Vulgarly called Magrums"
- ↑ 44.0 44.1 Harper P (2002). "Huntington's disease: a historical background". In Bates G, Harper P, Jones L (eds.). Huntington's Disease – Third Edition. Oxford: Oxford University Press. pp. 3–24. ISBN 978-0-19-851060-4.
- ↑ Wexler A, Wexler N (2008). The Woman Who Walked Into the Sea. Huntington's and the Making of a Genetic Disease. Yale University Press. p. 288. ISBN 978-0-300-10502-5. Retrieved 15 November 2015.
- ↑ . "Chorea Sti Viti i Sætersdalen. Uddrag af Distriktslæge J. C. Lunds Medicinalberetning for 1860".
- ↑ "About Huntington's Disease". Genome.gov (in ఇంగ్లీష్). Retrieved 13 January 2021.
- ↑ 48.0 48.1 History of the HDF". Hereditary Disease Foundation. Archived from the original on 19 November 2015. Retrieved 18 November 2015.
- ↑ 49.0 49.1 History and Genetics of Huntington's Disease | Huntington's Disease Society of America". March 2019. Retrieved 14 December 2020.
- ↑ (May 1915). "Huntington's Chorea in Relation to Heredity and Eugenics".
- ↑ . "The regulation of animal research and the emergence of animal ethics: a conceptual history".
- ↑ (February 2008). "The problem of deception in embryonic stem cell research".
- ↑ "Huntington Disease Dementia". emedicine, WebMD. Medscape. 2010. Archived from the original on 5 March 2010. Retrieved 16 May 2010.
- ↑ Driver-Dunckley E, Caviness JN (2007). "Huntington's disease". In Schapira AH (ed.). Neurology and Clinical Neuroscience. Mosby Elsevier. pp. 879–885. ISBN 978-0-323-03354-1.
- ↑ "US Senate s. resolution 531". S. Res. 531. US Senate. 6 April 2008. Archived from the original on 17 November 2015. Retrieved 10 August 2008.
- ↑ "The International Huntington Association". International Huntington Association. 2013. Archived from the original on 18 April 2009. Retrieved 3 April 2009.
- ↑ (May 2013). "EMQN/CMGS best practice guidelines for the molecular genetic testing of Huntington disease".