ఈథేన్
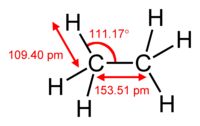 Molecular geometry of ethane based on rotational spectroscopy.
| |||
| |||

| |||
| పేర్లు | |||
|---|---|---|---|
| Preferred IUPAC name
Ethane[1] | |||
| Systematic IUPAC name
Dicarbane (never recommended[2]) | |||
| గుర్తింపు విషయాలు | |||
| సి.ఎ.ఎస్. సంఖ్య | [74-84-0] | ||
| పబ్ కెమ్ | 6324 | ||
| యూరోపియన్ కమిషన్ సంఖ్య | 200-814-8 | ||
| వైద్య విషయ శీర్షిక | Ethane | ||
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:42266 | ||
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | KH3800000 | ||
| SMILES | CC | ||
| బైల్ స్టెయిన్ సూచిక | 1730716 | ||
| జి.మెలిన్ సూచిక | 212 | ||
| ధర్మములు | |||
| C2H6 | |||
| మోలార్ ద్రవ్యరాశి | 30.07 g·mol−1 | ||
| స్వరూపం | Colorless gas | ||
| వాసన | Odorless | ||
| సాంద్రత |
544.0 kg/m3 (liquid at -88,5 °C) | ||
| ద్రవీభవన స్థానం | −182.8 °C; −296.9 °F; 90.4 K | ||
| బాష్పీభవన స్థానం | −88.5 °C; −127.4 °F; 184.6 K | ||
| 56.8 mg L−1[4] | |||
| బాష్ప పీడనం | 3.8453 MPa (at 21.1 °C) | ||
| kH | 19 nmol Pa−1 kg−1 | ||
| ఆమ్లత్వం (pKa) | 50 | ||
| Basicity (pKb) | −36 | ||
| అయస్కాంత ససెప్టిబిలిటి | -37.37·10−6 cm3/mol | ||
| ఉష్ణగతిక రసాయన శాస్త్రము | |||
| నిర్మాణము మారుటకు కావాల్సిన ప్రామాణిక ఎంథ్రఫీ ΔfH |
−84 kJ mol−1 | ||
| దహనక్రియకు కావాల్సిన ప్రామాణీక ఎంథ్రఫీ ΔcH |
−1561.0–−1560.4 kJ mol−1 | ||
| విశిష్టోష్ణ సామర్థ్యం, C | 52.49 J K−1 mol−1 | ||
| ప్రమాదాలు | |||
| భద్రత సమాచార పత్రము | inchem.org | ||
| జి.హెచ్.ఎస్.పటచిత్రాలు | 
| ||
| జి.హెచ్.ఎస్.సంకేత పదం | DANGER | ||
| జి.హెచ్.ఎస్.ప్రమాద ప్రకటనలు | H220, H280 | ||
| GHS precautionary statements | P210, P410+403 | ||
| జ్వలన స్థానం | {{{value}}} | ||
స్వయం జ్వలన
ఉష్ణోగ్రత |
472 °C (882 °F; 745 K) | ||
| విస్ఫోటక పరిమితులు | 2.9–13% | ||
| సంబంధిత సమ్మేళనాలు | |||
| Related {{{label}}} | {{{value}}} | ||
సంబంధిత సమ్మేళనాలు
|
|||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||
ఈథేన్ గది ఉష్ణోగ్రత, పీడనం వద్ద రంగులేని, వాసన లేని వాయువు. రసాయన సూత్రం c2H6.ఈథేన్ విషపూరితం కాదు. ఇది నాన్-టాక్సిక్గా పరిగణించబడుతుంది, అయినప్పటికీ ఇది గాలి కంటే ఎక్కువ దట్టంగా ఉండటం వలన ఊపిరాడకుండా చేస్తుంది.ఈథేన్ ఒక హైడ్రోకార్బన్. అంటే ఇది కేవలం హైడ్రోజన్, కార్బన్ పరమాణువుల నుండి తయారవుతుంది. ఈథేన్లో రెండు కార్బన్ పరమాణువులు, ఆరు హైడ్రోజన్ పరమాణువులు ఉన్నాయి.[5]ఈథేన్ మంచి ఇంధనం ఎందుకంటే ఇది సహజ వాయువు కంటే స్వచ్ఛమైన ఇంధనం. ఇది ద్రవ సహజ వాయువు కంటే వాల్యూమ్కు ఎక్కువ శక్తిని కూడా కలిగి ఉంటుంది.ఈథేన్ అనేక రకాల ఉపయోగాలు కలిగి ఉంది. ఇది ఇథిలీన్ను ఉత్పత్తి చేయడానికి ఉపయోగించబడుతుంది, ఇది ప్లాస్టిక్లకు, క్రయోజెనిక్ సిస్టమ్లకు రిఫ్రిజెరాంట్గా, ఇంధనంగా, సహజ వాయువు యొక్క ఒక భాగం.[5]
ఈథేన్ నిర్మాణాత్మకంగా ఒకే కార్బన్-కార్బన్ బంధాన్ని కలిగి ఉన్న సరళమైన హైడ్రోకార్బన్. సహజ వాయువు యొక్క రెండవ అతి ముఖ్యమైన భాగం, ఇది పెట్రోలియం నూనెలలో కరిగిపోతుంది, చమురు శుద్ధి కర్మాగారాల యొక్క ఉప-ఉత్పత్తి, బొగ్గు యొక్క కార్బొనైజేషన్ సమయంలో ఏర్పడును.[6]ఈథేన్ యొక్క పారిశ్రామిక ప్రాముఖ్యత వేడి గొట్టాల ద్వారా పంపినప్పుడు పైరోలిసిస్ లేదా క్రాకింగ్ ద్వారా ఇథిలీన్ (C2H4), హైడ్రోజన్గా మార్చబడుతుంది.ప్రొపేన్, కొంతవరకు బ్యూటేన్ లాగా, ఈథేన్ భారీ ఇథిలీన్ పెట్రోకెమికల్ పరిశ్రమకు ప్రధాన ముడి పదార్థం, ఇది పాలిథిలిన్ ప్లాస్టిక్, ఇథిలీన్ గ్లైకాల్, ఇథైల్ ఆల్కహాల్ వంటి ముఖ్యమైన ఉత్పత్తులను ఉత్పత్తి చేస్తుంది.[6] 1960లలో ఉత్పత్తి చేయబడిన ఈథేన్లో 90 శాతం కంటే ఎక్కువ సహజ వాయువు నుండి వేరు చేయకుండా ఇంధనంగా కాల్చబడింది.ఈథేన్ వాయువు ఒత్తిడిలో లేదా తగ్గిన ఉష్ణోగ్రతల వద్ద ద్రవీకరించబడుతుంది, తద్వారా సహజ వాయువు నుండి వేరు చేయబడుతుంది.ప్రొపేన్ వలె కాకుండా, ద్రవ ఈథేన్ పారిశ్రామిక లేదా గృహ ఇంధనంగా సాధారణ ఉపయోగంలో లేదు.[6]
చరిత్ర
[మార్చు]పొటాషియం అసిటేట్ ద్రావణం యొక్క విద్యుద్విశ్లేషణను వర్తింపజేయడం ద్వారా మైఖేల్ ఫెరడేచే 1834లో ఈథేన్ మొదటిసారిగా కృత్రిమంగా తయారు చేయబడింది. అతను ఈ చర్య యొక్క హైడ్రోకార్బన్ ఉత్పత్తిని మీథేన్గా తప్పుగా భావించాడు, దానిని మరింత పరిశోధించలేదు.[7]1847-1849 కాలంలో, ఆర్గానిక్ కెమిస్ట్రీ యొక్క రాడికల్ సిద్ధాంతాన్ని సమర్థించే ప్రయత్నంలో, హెర్మాన్ కోల్బే, ఎడ్వర్డ్ ఫ్రాంక్ల్యాండ్ ప్రొపియోనిట్రైల్ (ఇథైల్ సైనైడ్)[2], ఇథైల్ అయోడైడ్[3] పొటాషియం లోహంతో ( ఫెరడే చేసినట్లు) సజల అసిటేట్ల విద్యుద్విశ్లేషణ ద్వారా. తగ్గించడం/క్షయికరణ ద్వారా ఈథేన్ను ఉత్పత్తి చేశారు.అయినప్పటికీ, వారు ఈ ప్రతిచర్యల ఉత్పత్తిని మిథైల్, ఈథేన్ యొక్క డైమర్ కాకుండా మిథైల్ రాడికల్గా తప్పుగా భావించారు.ఈ లోపాన్ని 1864లో కార్ల్ స్కోర్లెమ్మర్ సరిదిద్దారు, అతను ఈ ప్రతిచర్యల యొక్క ఉత్పత్తి ఈథేన్ అని చూపించాడు.[8][9]
సంశ్లేషణ
[మార్చు]ఈథేన్ సంశ్లేషణ కోసం రసాయన సమీకరణం క్రింద ఇవ్వబడింది. ఆల్కహాల్లో జింక్, కాపర్తో ఇథైల్ అయోడైడ్ను తగ్గించడం ద్వారా ఈథేన్ సంశ్లేషణ చేయబడుతుంది.
- CH3CH2I + 2[H] → C2H6 + HI
మిథైల్ బ్రోమైడ్ లేదా మిథైల్ అయోడైడ్, సోడియం పొడి ఈథర్లో వేడి చేసినప్పుడు కూడా ఈథేన్ ఏర్పడుతుంది.
- CH3I + 2Na + CH3I → CH3 − CH3 + 2NaI
వాణిజ్య ఉత్పత్తి
[మార్చు]మీథేన్ తర్వాత, సహజ వాయువులో ఈథేన్ రెండవ అతిపెద్ద భాగం.వివిధ గ్యాస్ ఫీల్డ్ల నుండి వచ్చే సహజ వాయువు ఈథేన్ కంటెంట్లో 1 శాతం కంటే తక్కువ నుండి 6 శాతం వరకు ఉంటుంది.1960ల ముందు, ఈథేన్, పెద్ద అణువులు సాధారణంగా సహజ వాయువులోని మీథేన్ భాగం నుండి వేరు చేయబడవు, కానీ మీథేన్తో పాటు ఇంధనంగా మంDంచబడేవి.అయితే నేడు, ఈథేన్ ఒక ముఖ్యమైన పెట్రోకెమికల్ ఫీడ్స్టాక్,, ఇది చాలా బాగా అభివృద్ధి చెందిన వాయు క్షేత్రాలలో సహజ వాయువు యొక్క ఇతర భాగాల నుండి వేరు చేయబడుతున్నది.ఈథేన్ను పెట్రోలియం వాయువు నుండి కూడా వేరు చేయవచ్చు, పెట్రోలియం శుద్ధి యొక్క ఉప ఉత్పత్తిగా ఉత్పన్నమయ్యే వాయు హైడ్రోకార్బన్ల మిశ్రమం.[9]క్రయోజెనిక్ ఉష్ణోగ్రతల వద్ద ద్రవీకరించడం ద్వారా ఈథేన్, మీథేన్ నుండి అత్యంత సమర్థవంతంగా వేరు చేయబడుతుంది.
ప్రస్తుతం విస్తృత ఉపయోగంలో ఉన్న అత్యంత ఆర్థిక ప్రక్రియ, టర్బో ఎక్స్పాన్షన్.ఈ ప్రక్రియ ఉపయోగించి సహజ వాయువులోని ఈథేన్లో 90 శాతానికి పైగా తిరిగి పొందుతున్నారు.ఈ ప్రక్రియలో, చల్లబడిన వాయువు టర్బైన్ ద్వారా విస్తరిస్తుంది, అది విస్తరిస్తున్నప్పుడు, దాని ఉష్ణోగ్రత సుమారు -100 °Cకి పడిపోతుంది.ఈ తక్కువ ఉష్ణోగ్రత వద్ద, స్వేదనం ద్వారా ద్రవీకృత ఈథేన్, భారీ హైడ్రోకార్బన్ల నుండి వాయు మీథేన్ను వేరు చేయవచ్చు.తదుపరి స్వేదనం/బాష్పీకరణ ఈథేన్ను ప్రొపేన్, భారీ హైడ్రోకార్బన్ల నుండి వేరు చేస్తుంది.[9]
భౌతిక ధర్మాలు
[మార్చు]ఒక సాధారణ ఆల్కేన్, ఈథేన్, C2H6 అనే రసాయన సూత్రాన్ని కలిగి ఉన్నది.ఇది గది ఉష్ణోగ్రత వద్ద వాయువు గా వున్నను, -78.5 °C కంటే తక్కువ చల్లబడినప్పుడు ద్రవంగా మారుతుంది.[9]ఇది సులభంగా మండుతుంది. ఆవిర్లు గాలి కంటే బరువుగా ఉంటాయి. దీని ఆవిర్లు గాలిని స్థానభ్రంశం చెయడం వల్ల శ్వాస అందక ఉక్కిరిబిక్కిరి కావొచ్చు.మంటలు లేదా తీవ్రమైన వేడికి ఎక్కువ కాలం ఈథేన్ వున్న పాత్ర బహిర్గతం అయినప్పుడు నిల్వ పాత్రలు హింసాత్మకంగా పేలి/పగిలిపోవచ్చు. ద్రవంతో సంపర్కం వల్ల శరీరం గడ్డకట్టడం జరుగవచ్చు.[10]
| లక్షణం/గుణం | మితి/విలువ |
| రసాయన సూత్రం | C2H6[11] |
| అణు భారం | 30.07 గ్రా/మోల్[11] |
| సాంద్రత | 1.36 కిలో/ఘన మీటరు |
| ద్రవీభవన ఉష్ణోగ్రత | -172°C [12] |
| మరుగు స్థానం | -88°C[12] |
| ఫ్లాష్ పాయింట్ | -135 °C (-211 °F),closed cup. |
| బాష్పీభవన ఉష్ణశక్తి | 5.16కిలో జౌల్స్/మోల్,25°C[13][14] |
| వక్రీభవన గుణకం | 1.0377 @ 0 °C/D & 546 MM HG[15][14] |
| బాష్పపీడనం | 100 kPa,-88.8°C వద్ద[16][14] |
| తలతన్యత | 16 dynes/cm,-88°C,[17] |
ద్రావణీయత
[మార్చు]నీటిలో ఈథేన్ వాయువు కరుగుతుంది. 25 °C వద్ద లీటరు నీటిలో 60.2 మీ గ్రాముల వాయువు కరుగుతుంది.[18]బెంజీన్లో బాగా కరుగుతుంది.[19]4 °C వద్ద 46 మి.లీ వాయువు/100మి.లీ ఆల్కహాల్ లో కరుగుతుంది.[20]ఈథర్లో కరుగుతుంది.
రసాయన చర్యలు
[మార్చు]దహన క్రియ
[మార్చు]ఈథేన్ వాయువును గాలితో(ఆక్సిజన్)తో కలిపి మండించినపుడు కార్బన్ డై ఆక్సైడ్,నీరు, ఉష్ణశక్తి వెలువడును.
- C2H6 +3.5 O2 → 2CO2+3H2O+1560KJ(ఉష్ణశక్తి)
లేదా
- 2C2H6+7.O2 → 4CO2+6H2O+3120KJ(ఉష్ణశక్తి)
పైరోలిసిస్ ప్రక్రియ
[మార్చు]ఇది పైరోలిసిస్ ప్రక్రియ ద్వారా ఇథిలీన్ ఉత్పత్తికి ముడి పదార్థంగా పనిచేస్తుంది.[21]
- CH3CH3 → CH2CH2+H2
నైట్రిక్ ఆమ్లం ఆవిర్లతో చర్య
[మార్చు]ఈథేన్ 400°C వద్ద నైట్రిక్ యాసిడ్ ఆవిరితో చర్య జరిపి నైట్రోఈథేన్ను ఏర్పరుస్తుంది.ఉల్లేఖన లోపం: తెరిచే <ref> ట్యాగు సరిగ్గా లేదు, లేదా దాని పేరు సరైనది కాదు
- C2H6+HONO2 →C2H5NO2+H2O
ఉపయోగాలు
[మార్చు]- ఈథేన్ ప్రధానంగా ఇథిలీన్ను ఉత్పత్తి చేయడానికి ఉపయోగించబడుతుంది, ఇది పెట్రోకెమికల్ పరిశ్రమ ద్వారా ఇంటర్మీడియట్ ఉత్పత్తుల శ్రేణిని ఉత్పత్తి చేయడానికి ఉపయోగించబడుతుంది, వీటిలో ఎక్కువ భాగం ప్లాస్టిక్లుగా మార్చబడతాయి.[22]
- ఈథేన్ నేరుగా విద్యుత్ ఉత్పత్తికి ఇంధనంగా కూడా ఉపయోగించవచ్చు, దాని స్వంత లేదా సహజ వాయువుతో మిళితం చేయబడుతుంది.[22]
- ఇథనాల్, ఎసిటాల్డిహైడ్, ఎసిటిక్ యాసిడ్ తయారీలో ఉపయోగిస్తారు, ఇవి పెయింట్లు, వార్నిష్లు, అతికే పదార్థాలు, ప్లాస్టిక్ మొదలైన వాటిలో ఉపయోగించబడును.[23]
- ఈథేన్ను శీతలకరణిగా ఉపయోగిస్తారు.ఈథేన్ ను ఈథీన్, ఇథనాల్ తయారీలో ఉపయోగించబడుతుంది.[24]
దుష్పలితాలు
[మార్చు]ఈథేన్ వాయువు ప్రభావానికి మనిష్ లోనయిపుడు మైకము, వికారం, మగత, వాంతులు, అధిక లాలాజలము, చలనము/స్పృహ కోల్పోవటానికి కారణం కావచ్చు. అధిక పీడనం,/లేదా ఉష్ణోగ్రత వద్ద గాలి లేనప్పుడు కూడా పేలుడుగా స్పందించవచ్చు.[25]
మూలాలు
[మార్చు]- ↑ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 133. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
The saturated unbranched acyclic hydrocarbons C2H6, C3H8, and C4H10 have the retained names ethane, propane, and butane, respectively.
- ↑ IUPAC 2014, p. 4. "Similarly, the retained names 'ethane', 'propane', and 'butane' were never replaced by systematic names 'dicarbane', 'tricarbane', and 'tetracarbane' as recommended for analogues of silane, 'disilane'; phosphane, 'triphosphane'; and sulfane, 'tetrasulfane'."
- ↑ "Ethane – Compound Summary". PubChem Compound. US: National Center for Biotechnology Information. 16 September 2004. Retrieved 7 December 2011.
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 8.88. ISBN 0-8493-0486-5.
- ↑ 5.0 5.1 "Ethane". study.com. Retrieved 2024-04-15.
- ↑ 6.0 6.1 6.2 "ethane". britannica.com. Retrieved 2024-04-15.
- ↑ Michael Faraday, Experimental researches in electricity: Seventh series, Philosophical Transactions 124:77–122.
- ↑ Carl Schorlemmer, Annalen der Chimie (1864) 132:234.
- ↑ 9.0 9.1 9.2 9.3 "Ethane". newworldencyclopedia.org. Retrieved 2024-04-15.
- ↑ "ETHANE". cameochemicals.noaa.gov. Retrieved 2024-04-15.
- ↑ 11.0 11.1 "Ethane Formula". pw.live. Retrieved 2024-04-15.
- ↑ 12.0 12.1 "Ethane". sigmaaldrich.com. Retrieved 2024-04-15.
- ↑ Haynes, W.M. (ed.). CRC Handbook of Chemistry and Physics. 94th Edition. CRC Press LLC, Boca Raton: FL 2013-2014, p. 6-137
- ↑ 14.0 14.1 14.2 "ethane". pubchem.ncbi.nlm.nih.gov. Retrieved 2024-04-15.
- ↑ Weast, R.C. (ed.) Handbook of Chemistry and Physics. 69th ed. Boca Raton, FL: CRC Press Inc., 1988-1989., p. C-263
- ↑ Haynes, W.M. (ed.). CRC Handbook of Chemistry and Physics. 94th Edition. CRC Press LLC, Boca Raton: FL 2013-2014, p. 6-96
- ↑ U.S. Coast Guard, Department of Transportation. CHRIS - Hazardous Chemical Data. Volume II. Washington, D.C.: U.S. Government Printing Office, 1984-5.
- ↑ McAuliffe C; J Phys Chem 70: 1267-75 (1966)
- ↑ Haynes, W.M. (ed.). CRC Handbook of Chemistry and Physics. 94th Edition. CRC Press LLC, Boca Raton: FL 2013-2014, p. 3-244
- ↑ O'Neil, M.J. (ed.). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Cambridge, UK: Royal Society of Chemistry, 2013., p. 690
- ↑ "etane". vedantu.com. Retrieved 2024-04-16.
- ↑ 22.0 22.1 "Hydrocarbon gas liquids explained". eia.gov. Retrieved 2024-04-16.
- ↑ "Uses of Ethane –". byjus.com. Retrieved 2024-04-16.
- ↑ "What are the uses of ethane?". learnatnoon.com/. Retrieved 2024-04-16.[permanent dead link]
- ↑ "SAFETY DATA SHEET" (PDF). mesagas.co. Retrieved 2024-04-16.


