పరమాణువు
| హీలియం పరమాణువు | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| హీలియం పరమాణువు చిత్రంలో పరమాణు కేంద్రకం (పింక్), ఎలక్ట్రాన్ మేఘం విస్తరణ (నలుపు) రంగులో సూచించబడినవి. పరమాణు కేంద్రకం (పైన కుడివైపు) హీలియం-4 సాపేక్షంగా గోళాకారంగా సౌష్టవంగా ఉండి దగ్గరలో ఎలక్ట్రాన్ మేఘం ఆవరించబడి ఉంది. నలుపు బార్ "ఆంగ్స్ట్రాం"(10−10 మీ. లేదా 100 pమీ.). | ||||||||
| వర్గీకరణ | ||||||||
| ||||||||
| ధర్మములు | ||||||||
|
ఒక పరమాణువు అనేది రసాయన మూలకాన్ని ఏర్పరిచే సాధారణ పదార్థం యొక్క అతి చిన్న యూనిట్. ప్రతి ఘన, ద్రవ, వాయు, ప్లాస్మా పదార్థాలు తటస్థ లేదా అయోనైజ్డ్ పరమాణువులతో కూడి ఉంటాయి. పరమాణువులు చాలా చిన్నవి, అవి సాధారణంగా 100 పికోమీటర్ల పరిమాణం కలిగి ఉంటాయి. వాటి ప్రవర్తనను సాంప్రదాయక భౌతికశాస్త్రాన్ని ఉపయోగించి కచ్చితంగా అంచనా వెస్తే - అవి టెన్నిస్ బంతుల ఆకారంలో ఉంటాయి.
ప్రతి పరమాణువు పరమాణు కేంద్రకం, దాని చుట్టూ పరిభ్రమణం చేసే ఒకటి లేదా ఎక్కువ ఎలక్త్రాన్లను కలిగి ఉంటుంది. పరమాణు కేంద్రకం ఒకటి లేదా అంతకంటే ఎక్కువ ప్రోటాన్లు, అనేక న్యూట్రాన్లను కలిగి ఉంటుంది. అన్ని మూలకాలలో వలె కాకుండా హైడ్రోజన్ పరమాణువులో న్యూట్రాన్లు ఉండవు. 99.94% కంటే ఎక్కువ ద్రవ్యరాశి పరమాణు కేంద్రకంలో ఉంటుంది. పరమాణువులో ప్రోటాన్లు ధనావేశాన్ని, ఎలక్ట్రాన్లు ఋణావేశాన్ని కలిగిఉంటాయి. ఒక పరమాణువులో ఎలక్ట్రాన్ల సంఖ్య, ప్రోటాన్ల సంఖ్యకు సమానంగా ఉంటే అది విద్యుత్ పరంగా తటస్థంగా ఉంటుంది. పరమాణువులో ప్రోటాన్ల సంఖ్య కన్నా ఎక్కువ లేదా తక్కువ ఎలక్ట్రాన్లు ఉంటే అపుడు పరమాణువు ఋణావేశం లేదా ధనావేశాన్ని కలిగి ఉంటుంది. అటువంటి ఆవేశం గల కణాలను అయాన్లు అంటారు.
ఒక పరమాణువులోని ఎలక్ట్రాన్లు, పరమాణు కేంద్రకంలోని ప్రోటాన్లు విద్యుదయస్కాంత బలం వల్ల పరస్పరం ఆకర్షించబడుతూ ఉంటాయి. కేంద్రకంలోని ప్రోటాన్లు, న్యూట్రాన్లు కేంద్రక బలం వల్ల బంధించబడి ఉంటాయి. ఈ బలం ధనావేశం గల ప్రోటాన్ల మధ్య గల వికర్షణ బలం కంటే ఎక్కువగా ఉంటుంది. కొన్ని పరిస్థితులలో ఈ వికర్షణ బలం కేంద్రక బలం కంటే ఎక్కువ అవుతుంది. ఈ సందర్భంలో కేంద్రకం విడిపోయి వేర్వేరు మూలకాలుగా మారుతుంది. దీనిని కేంద్రక విఘటనం అంటారు.
పరమాణు కేంద్రకంలో గల ప్రోటాన్ల సంఖ్యను పరమాణు సంఖ్య అంటారు. ఇది అది ఏ రసాయమ మూలక పరమాణువో తెలుస్తుంది. ఉదాహరణకు పరమాణు కేంద్రకంలో 29 ప్రోటాన్లు కల మూలకం కాపర్ అని తెలుస్తుంది. న్యూట్రానుల సంఖ్య ఆ మూలకం ఐసోటోపులను నిర్వచిస్తుంది. ఒకటి లేదా అంతకంటే ఎక్కువ పరమాణువులు రసాయన బంధాల ద్వారా కలిసి అణువులు, స్ఫటికాలు వంటి రసాయన సమ్మేళనాలు ఏర్పడతాయి. ప్రకృతిలో సంభవించిన చాలా భౌతిక మార్పులకు పరమాణువుల కలయిక, విడిపోవడం కలుగుతుంది. ఈ మార్పులను అధ్యయనాన్ని రసాయనశాస్త్రం వివరిస్తుంది.
పరమాణు సిద్ధాంత చరిత్ర
[మార్చు]తత్వశాస్త్రంలో
[మార్చు]పదార్థం చిన్న విభజించలేని కణాలతో తయారవుతుందనే ప్రాథమిక ఆలోచన గ్రీసు, భారతదేశం వంటి అనేక ప్రాచీన సంస్కృతులలో కనిపిస్తుంది. ఈ పురాతన ఆలోచన శాస్త్రీయ కారణాల కంటే తాత్విక కారణాలపై ఆధారపడి ఉంది. "Atom" అనే పదం గ్రీకు పదమైన "atomos" నుండి వ్యుత్పత్తి అయినది. గ్రీకు భాషలో దీని అర్థం "విభజించరానిది".[1][2]
డాల్టన్ బహ్వానుపాత నియమం
[మార్చు]
1800 ల ప్రారంభంలో, జాన్ డాల్టన్ తాను, ఇతర శాస్త్రవేత్తలు సేకరించిన ప్రయోగాత్మక సమాచారాన్ని సంకలనం చేశాడు. రసాయన మూలకాలు వాటి బరువుల సరళ పూర్ణాంకాల నిష్పత్తిలో సంయోగం చెందుతాయని గమనించాడు. ఈ నియమాన్ని "బహ్వాను పాత నియమం" అని పిలుస్తారు. సరళ నిష్పత్తుల ద్వారా అతను మూలకాలు వాటి ద్రవ్యరాశి యొక్క ప్రాధమిక యూనిట్ల గుణకాలలో సంయోగం చెందుతున్నాయని, ఈ ప్రాధమిక యూనిట్ ను డాల్టన్ "పరమాణువు" అని నిర్థారించాడు.
ఉదాహరణకు, టిన్ ఆక్సైడ్లో రెండు రకాలు ఉన్నాయి: ఒకటి నల్లటి పొడి 88.1% టిన్, 11.9% ఆక్సిజన్, మరొకటి 78.7% టిన్, 21.3% ఆక్సిజన్ కలిగిన తెల్లటి పొడి. ఈ గణాంకాలను సర్దుబాటు చేస్తే, నల్లని ఆక్సైడ్ లో 100 గ్రాముల టిన్ కు 13.5 గ్రా ఆక్సిజన్, తెల్లని ఆక్సైడ్ లో 100 గ్రాముల టిన్కు 27 గ్రా. ఆక్సిజన్ కలిగి ఉంది. 13.5, 27 ల నిష్పత్తి 1:2 అనేది చిన్న పూర్ణాంక సంఖ్యలు. ఈ ఆక్సైడ్లలో ప్రతీ టిన్ పరమాణువు ఒకటి లేదా రెండు ఆక్సిజన్ పరమాణువులతో కలుస్తుంది. అవి (SnO and SnO2).[3][4]
రెండవ ఉదాహరణగా, డాల్టన్ రెండు ఐరన్ ఆక్సైడ్లను పరిగణించాడు: 78.1% ఇనుము, 21.9% ఆక్సిజన్ కలిగిన నల్లని పొడి, 70.4% ఇనుము, 29.6% ఆక్సిజన్ గల ఎర్రని పొడి. ఈ సంఖ్యలను సర్దుబాటు చేస్తే, నల్లని ఆక్సైడ్ లో 100 గ్రాముల ఇనుముకు 28 గ్రాముల ఆక్సిజన్, ఎర్రని ఆక్సైడ్ లో 100 గ్రాముల ఇనుముకు 42 గ్రాముల ఆక్సిజన్ కలిసింది. 28, 42 ల సాధారణ నిష్పత్తి 2:3. ఈ సంబంధిత ఆక్సైడ్లలో ప్రతీ రెండు ఇనుము పరమాణువులు రెండు లేదా మూడు పరమాణువుల ఆక్సిజన్ కలిసినట్లు తెలుస్తుంది. అవి (Fe2O2 and Fe2O3)[a].[5][6]
అంతిమ ఉదాహరణగా: నైట్రస్ ఆక్సైడ్ లో 63.3% నత్రజని, 36.7% ఆక్సిజన్, నైట్రిక్ ఆక్సైడ్ లో 44.05% నత్రజని, 55.95% ఆక్సిజన్, నైటోజన్ డయాక్సైడ్ లో 29.5%, 70.5% ఆక్సిజన్ ఉంటుంది. - గణాంకాలను సర్దుబాటు చేస్తే ప్రతి 140 గ్రాముల నత్రజని వరుసగా సుమారు 80గ్రా., 160 గ్రా, 320గ్రా ల ఆక్సిజన్ తో కలసి పై ఆక్సైడ్లను ఏర్పరుస్తుంది. నత్రజని ఆక్సైడ్లలో నత్రజని ఆక్సిజన్ తో కలయిక 1: 2: 4 సామాన్య నిష్పత్తిని కలిగి ఉంటుంది. ఈ ఆక్సైడ్లకు సంబంధించిన సూత్రాలు N2 O, NO, NO 2 .[7][8]
వాయువుల గతి సిద్ధాంతం
[మార్చు]18 వ శతాబ్దం చివరలో, అనేకమంది శాస్త్రవేత్తలు వాయువుల ప్రవర్తనను ఉప-సూక్ష్మ కణాల సముదాయంగా వర్ణించడం ద్వారా, వాటి గణాంకాలు, సంభావ్యతల నుపయోగించి వాటి ప్రవర్తనను నమూనాలుగా చేయడం ద్వారా బాగా వివరించవచ్చిమమొ కనుగొన్నారు. డాల్టన్ పరమాణు సిద్ధాంతం వలె కాకుండా, వాయువుల గతి సిద్ధాంతం వాయువులు ఒకదానితో ఒకటి సంయోగం చెంది రసాయనికంగా ఎలా సమ్మేళనాలుగా ఏర్పడతాయో వివరించలేదు. కానీ అవి భౌతికంగా ఎలా ప్రవర్తిస్తాయో వివరించగలిగింది అవి: విస్తరణ, స్నిగ్ధత, వాహకత, పీడనం మొదలైనవి.
బ్రౌనియన్ చలనం
[మార్చు]1827 లో, వృక్షశాస్త్రజ్ఞుడు రాబర్ట్ బ్రౌన్ నీటిలో తేలియాడే ధూళి కణాలను చూడటానికి సూక్ష్మదర్శినిని ఉపయోగించాడు. అవి అస్తవ్యస్థంగా (ఒక నియమం లేక సంచరించుట) కదులుతున్నాయని కనుగొన్నాడు, ఈ దృగ్విషయాన్ని బ్రౌనియన్ చలనం అంటారు. నీటి అణువులు రేణువులను ఢీ కొట్టడం వల్ల ఈ చలనం సంభవిస్తుందని భావించాడు. 1905 లో, బ్రౌనియన్ చలనం యొక్క మొదటి గణాంక భౌతిక విశ్లేషణను రూపొందించడం ద్వారా ఆల్బర్ట్ ఐన్స్టీన్ ఈ అణువుల యొక్క వాస్తవికతను, వాటి కదలికలను నిరూపించాడు.[9][10] ఫ్రెంచ్ భౌతిక శాస్త్రవేత్త జీన్ పెరిన్ ఐన్స్టీన్ చేసిన పనిని ఉపయోగించి అణువుల ద్రవ్యరాశి, వాటి కొలతలు ప్రయోగాత్మకంగా నిర్ణయించాడు. తద్వారా పదార్థం యొక్క కణ స్వభావానికి భౌతిక ఆధారాలు లభించాయి.
ఎలక్ట్రాన్ ఆవిష్కరణ
[మార్చు]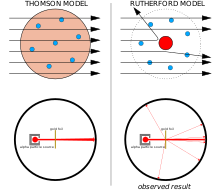
ఎడమ: ఆశించిన ఫలితాలు: అతి తక్కువ విక్షేపణతో పరమాణువు యొక్క ప్లమ్ పుడ్డింగ్ మోడల్ గుండా వెళుతున్న ఆల్ఫా కణాలు.
కుడి: గమనించిన ఫలితాలు: కణాలలో కొద్ది భాగం పరమాణువు యొక్క ధనాత్మక కేంద్రకం వద్ద విక్షేపణం చెందినవి.
1897 లో, ఋణధృవ కిరణాలు విద్యుదయస్కాంత తరంగాలు కాదని, హైడ్రోజన్ (తేలికైన పరమాణువు) కంటే 1,800 వంతు తేలికైన కణాలతో తయారయ్యాయని జెజె థామ్సన్ కనుగొన్నాడు. అందువల్ల అవి పరమాణువులు కాదని, అవి కొత్త కణాలని కనుగొన్నాడు. ఉప పరమాణు కణాలలో ఇవి మొట్టమొదట కనుగొన్న కణాలు. అతను ఈ కొత్త కణాలను కార్పసెల్స్ (సూక్ష్మ కణాలు) అని పిలిచాడు. కాని తరువాత వాటిని ఎలక్ట్రాన్లు అని పేరు మార్చారు. ఎలెక్ట్రాన్లు ఫోటో ఎలెక్ట్రిక్, రేడియోధార్మిక పదార్థాలచే వెలువడుతున్న కణాలకు సమానంగా ఉన్నాయని థామ్సన్ చూపించాడు.[11] ఎలక్ట్రాన్లు లోహపు తీగలలో విద్యుత్ ప్రవాహాలను తీసుకువెళ్ళే కణాలు అని త్వరగా గుర్తించబడింది. థామ్సన్ ఈ ఎలక్ట్రాన్లు తన పరికరాలలో (ఉత్సర్గనాళం) ఋణధృవం (కాథోడ్) వద్ద పరమాణువుల నుండి ఉద్భవించాయని తేల్చిచెప్పాడు. అప్పటికి పరమాణువు విభజింప రానిదని, దానికి "అటోమస్" (విభజించ రానివి) అని పేరు పెట్టడం జరిగింది. కానీ థామ్సన్ తన ఉత్సర్గనాళ ప్రయోగాల ద్వారా పరమాణువులోని మొదటి ఉప పరమాణు కణం (ఎలక్ట్రాన్) ను కనుగొన్నాడు.
కేంద్రకం ఆవిష్కరణ
[మార్చు]ఋణాత్మక ఆవేశ ఎలక్ట్రాన్లు పరమాణువు అంతటా ధనాత్మక ఆవేశ సముద్రంలో పంపిణీ చేయబడి ఉన్నాయని, ఇది పరమాణువు మొత్తం ఘనపరిమాణంలో పంపిణీ చేయబడిందని జె.జె. థామ్సన్ భావించాడు.[12] ఈ నమూనాను ప్లమ్ పుడ్డింగ్ పరమాణు నమూనా అని పిలుస్తారు. ప్లమ్ పుడ్డింగ్ అంటే ఒకరకమైన తినుబండారం. ఇందులో ప్లమ్స్ (ఒక రకమైన పండ్లు) వెదజల్లినట్లుగా పరమాణువులో ఎలక్ట్రాన్లు కూడా వెదజల్లినట్లు ఉంటాయని భావించడం వల్ల దీనికాపేరు వచ్చింది.
ఎర్నెస్ట్ రూథర్ఫోర్డ్ , అతని సహచరులు హాన్స్ గైగర్, ఎర్నెస్ట్ మార్స్డెన్ లు ఆల్ఫా కణాల (రేడియం వంటి రేడియోధార్మిక పదార్థాల నుండి ఉద్గారయ్యే ధనావేశ కణాలు) ఆవేశం-ద్రవ్యరాశి నిష్పత్తి (e/m) విలువను కనుగొనడానికి ఒక పరికరాన్ని నిర్మించడానికి ప్రయత్నించినప్పుడు ఏర్పడిన ఇబ్బందులు ఎదుర్కొన్న తరువాత థామ్సన్ నమూనా గురించి సందేహాలు వచ్చాయి. శోధక చాంబర్లో ఆల్ఫా కణాలు గాలి ద్వారా పరిక్షేపణం (చెల్లాచెదురుగా కావడం) చెందడం వలన కొలతలను నమ్మదలేనట్లుగా చేసింది. కాథోడ్ కిరణాలపై తన పరిశోధనలో థామ్సన్ ఇలాంటి సమస్యను ఎదుర్కొన్నాడు. అతను తన పరికరాలలో (ఉత్సర్గ నాళాలు) ఖచ్చితమైన శూన్యతను సృష్టించడం ద్వారా పరిష్కరించాడు. ఆల్ఫా కణాలు ఎలక్ట్రాన్ల కన్నా చాలా బరువుగా ఉన్నందున అతను ఇదే సమస్యలో పడ్డాడని రూథర్ఫోర్డ్ అనుకోలేదు. పరమాణువు యొక్క థామ్సన్ నమూనా ప్రకారం, పరమాణువులోని ధనావేశ ఆల్ఫా కణాన్ని విచలనం చేసేంత శక్తివంతమైన విద్యుత్ క్షేత్రాన్ని ఉత్పత్తి చేయడానికి తగినంతగా ధనావేశం కేంద్రీకృతమై లేదు, ఎలక్ట్రాన్లు చాలా తేలికగా ఉంటాయి. అవి చాలా బరువైన ఆల్ఫా కణాల ద్వారా అప్రయత్నంగా పక్కకు నెట్టబడాలి. ఇంకా పరిక్షేపణ చెందడం జరిగింది. కాబట్టి రూథర్ఫోర్డ్ తో పాటు అతని సహచరులు ఈ పరిక్షేపణాన్ని జాగ్రత్తగా పరిశోధించాలని నిర్ణయించుకున్నారు.[13]
1908, 1913 ల మధ్య, రూథర్ఫోర్డ్ తో పాటు అతని సహచరులు వరుస ప్రయోగాలు చేశారు. దీనిలో వారు లోహపు పలుచని రేకులపై ఆల్ఫా కణాలతో తాడనం చేసారు. వారు కొన్ని ఆల్ఫా కణాలు 90° ల కన్నా ఎక్కువ కోణాలలో విక్షేపం చేస్తున్నట్లు గుర్తించారు. దీనిని వివరించడానికి, థామ్సన్ భావిస్తున్నట్లుగా పరమాణువు లోని ధనాత్మక ఆవేశం పరమాణువు ఘనపరిమాణం అంతటా పంపిణీ చేయబడదని రూథర్ఫోర్డ్ ప్రతిపాదించాడు. కానీ పరమాణువు మధ్యలో ఒక చిన్న కేంద్రకంలో ధనావేశమంతా కేంద్రీకృతమై ఉంది. అటువంటి హెచ్చు ఆవేశ సాంద్రత మాత్రమే ఆల్ఫా కణాలను విక్షేపం చేసేంత బలమైన విద్యుత్ క్షేత్రాన్ని ఉత్పత్తి చేస్తుంది.[13]
ఐసోటోపుల ఆవిష్కరణ
[మార్చు]రేడియోధార్మిక విఘటనం యొక్క ఉత్పత్తులతో ప్రయోగాలు చేస్తున్నప్పుడు, 1913 లో రేడియో రసాయనశాస్త్రవేత్త ఫ్రెడరిక్ సోడి ఆవర్తన పట్టికలో ప్రతి స్థానం వద్ద ఒకటి కంటే ఎక్కువ ఒకే రకమైన పరమాణువులు ఉన్నట్లు కనుగొన్నాడు. ఐసోటోప్ అనే పదాన్ని ఒకే మూలకానికి చెందిన వివిధ పరమాణువులకు తగిన పేరుగా మార్గరెట్ టాడ్ ఉపయోగించాడు. జెజె థామ్సన్ అయోయనీకరణ వాయువులపై తన పరిశోధన ద్వారా ఐసోటోప్ విభజన కోసం ఒక సాంకేతికతను సృష్టించాడు, తరువాత ఇది స్థిరమైన ఐసోటోపుల ఆవిష్కరణకు దారితీసింది.
బోర్ పరమాణు నమూనా
[మార్చు]
1913 లో భౌతిక శాస్త్రవేత్త నీల్స్ బోర్ ఒక నమూనాను ప్రతిపాదించాడు. దీనిలో ఒక పరమాణువు లోని ఎలక్ట్రాన్లు కేంద్రకం చుట్టూ నిర్ధిష్ట కక్ష్యలలో తిరుగుతుంటాయని ఊహించాడు. అయితే ఇది నిర్ధిష్ట కక్ష్యలో మాత్రమే జరుగుతుంది. ఈ కక్ష్యల మధ్య శోషణ లేదా ఫోటాన్ల రేడియేషన్ కు సరిపోయే శక్తి మార్పులు జరిగినపుడు ఎలక్ట్రాన్లు వివిధ కక్ష్యలలోకి దూకుతాయి. ఎలక్ట్రాన్ల కక్ష్యలు ఎందుకు స్థిరంగా (సాధారణంగా, వృత్తాకార చలనంలో త్వరణంలో ఉన్న ఆవేశాలు, విద్యుదయస్కాంత వికిరణంగా విడుదలయ్యే గతి శక్తిని కోల్పోతాయి, సింక్రోట్రోన్ రేడియేషన్ చూడండి) ఉన్నాయో వివరించడానికి, మూలకాలు వివిక్తం వర్ణపటం లో విద్యుదయస్కాంత వికిరణాన్ని ఎందుకు గ్రహిస్తాయో ఈ క్వాంటీకరణం వివరిస్తుంది.
అదే సంవత్సరం తరువాత హెన్రీ మోస్లీ నీల్స్ బోర్ సిద్ధాంతానికి అనుకూలంగా అదనపు ప్రయోగాత్మక ఆధారాలను అందించాడు. ఈ ఫలితాలు ఎర్నెస్ట్ రూథర్ఫోర్డ్, ఆంటోనియస్ వాన్ డెన్ బ్రూక్ యొక్క నమూనాను మెరుగు పరిచాయి. ఇది పరమాణువు దాని కేంద్రకంలో అనేక ధనావేశ కణాలను కలిగి ఉందని ప్రతిపాదించింది. ఇది ఆవర్తన పట్టికలోని దాని (పరమాణు) సంఖ్యకు సమానం. ఈ ప్రయోగాలు చేసే వరకు, పరమాణు సంఖ్య భౌతిక, ప్రయోగాత్మక పరిమాణంగా తెలియదు. పరమాణు సంఖ్య ఆ పరమాణు కేంద్రకంలోని ధనావేశ కణాల మొత్తానికి సమానమని ఈనాటికీ అంగీకరించబడి పరమాణు నమూనాగా మిగిలిపోయింది.[14]
పరమాణువుల మధ్య రసాయన బంధాలను గిల్బర్ట్ న్యూటన్ లూయిస్ 1916 లో వివరించాడు. ఆయన వాటి ఎలక్ట్రాన్ల మధ్య పరస్పర మార్పిడి వలన ఏర్పడుతాయని తెలియజేసాడు. మూలకాల యొక్క రసాయన లక్షణాలు ఆవర్తన నియమం ప్రకారం తమను తాము ఎక్కువగా పునరావృతం చేస్తాయని తెలిసినందున,[15] 1919 లో అమెరికన్ రసాయన శాస్త్రవేత్త ఇర్వింగ్ లాంగ్ముయిర్ ఒక పరమాణువులోని ఎలక్ట్రాన్లు ఏదో ఒక విధంగా అనుసంధానించబడి లేదా సమూహంగా ఉంటే రసాయన బంధాన్ని వివరించవచ్చని సూచించాడు. ఎలక్ట్రాన్ల సమూహాలు కేంద్రకం చుట్టూ ఎలక్ట్రాన్ల కక్ష్యలను ఆక్రమిస్తాయి.
పరమాణువు యొక్క బోర్ నమూనా పరమాణువుకు మొదటి పూర్తి భౌతిక నమూనా. ఇది అణువు యొక్క మొత్తం నిర్మాణాన్ని, పరమాణువులు ఒకదానితో ఒకటి ఎలా బంధిస్తాయో, హైడ్రోజన్ యొక్క వర్ణపట రేఖలను అంచనా వేసింది. బోర్ పరమాణు నమూనా పరిపూర్ణంగా లేదు. త్వరలో దీనికంటే ఖచ్చితమైన ష్రోయిడింగర్ నమూనా (క్రింద చూడండి) ను అధికమించింది. అయితే పదార్థం పరమాణువులతో కూడి ఉందనే సందేహాలను నివృత్తి చేయడానికి ఇది సరిపోతుంది. రసాయన శాస్త్రవేత్తల కోసం, పరమాణువు యొక్క ఆలోచన ఉపయోగకరమైన అన్వేషణా సాధనంగా ఉంది, కాని పరమాణువు యొక్క పూర్తి భౌతిక నమూనాను ఎవరూ ఇంకా అభివృద్ధి చేయనందున పదార్థం నిజంగా పరమాణువులతో తయారైందా అనే సందేహం భౌతిక శాస్త్రవేత్తలకు ఉంది.
ష్రోడింగర్ నమూనా
[మార్చు]1922 లోని స్టెర్న్-గెర్లాచ్ ప్రయోగం పరమాణు లక్షణాల క్వాంటం స్వభావానికి మరింత ఆధారాలను అందించింది. వెండి పరమాణువుల పుంజం ప్రత్యేకంగా ఆకారంలో ఉన్న అయస్కాంత క్షేత్రం గుండా వెళ్ళినప్పుడు, పుంజం పరమాణువు కోణీయ ద్రవ్యవేగం లేదా స్పిన్ యొక్క దిశతో సంబంధం ఉన్న విధంగా విచలనం చెందుతుంది. ఈ స్పిన్ దిశ మొదట్లో క్రమ రహితంగా ఉన్నందున, పుంజం క్రమ రహిత దిశలో విక్షేపం చెందుతుందని భావించారు. దీనికి బదులుగా పుంజం రెండు దిశాత్మక భాగాలుగా విభజించబడింది, అయస్కాంత క్షేత్రానికి సంబంధించి పరమాణువు స్పిన్ పైకి లేదా క్రిందికి ఆధారితంగా ఉంటుంది.
1925 లో వెర్నర్ హైసెన్బర్గ్ క్వాంటం మెకానిక్స్ ( మ్యాట్రిక్స్ మెకానిక్స్ ) యొక్క మొదటి స్థిరమైన గణిత సూత్రీకరణను ప్రచురించాడు.[14] ఒక సంవత్సరం ముందు, లూయిస్ డి బ్రోగ్లీ డి బ్రోగ్లీ పరికల్పనను ప్రతిపాదించాడు : అన్ని కణాలు కొంతవరకు తరంగాల వలె ప్రవర్తిస్తాయి,[16] 1926 లో ఎర్విన్ ష్రోడింగర్ ఈ ఆలోచనను పరమాణువు యొక్క గణిత నమూనా (వేవ్ మెకానిక్స్ ) అయిన ష్రోడింగర్ సమీకరణాన్ని అభివృద్ధి చేయడానికి ఉపయోగించాడు. ఎలక్ట్రాన్లను బిందు కణాల కంటే త్రిమితీయ తరంగ రూపాలుగా వర్ణించారు.[17]
కణాలను వివరించడానికి తరంగ రూపాలను ఉపయోగించడం యొక్క పరిణామం ఏమిటంటే, ఒక నిర్దిష్ట సమయంలో ఒక కణం యొక్క స్థానం, ద్రవ్యవేగం రెండింటికీ ఖచ్చితమైన విలువలను పొందడం గణితశాస్త్రంలో అసాధ్యం; దీనిని హైసన్ బర్గ్ అనిశ్చితత్వ నియమం అంటారు. దీనిని 1927 లో రూపొందించాడు.[14] ఈ భావనలో, ఒక కణం స్థానాన్ని కొలవడంలో ఇచ్చిన ఖచ్చితత్వం కోసం, ద్రవ్యవేగం కోసం సంభావ్య విలువల శ్రేణిని మాత్రమే పొందవచ్చు. అదే విధంగా ద్రవ్యవేగాన్ని ఖచ్చితంగా కొలవడంలో స్థానం కోసం సంభావ్య విలువను పొందవచ్చు.[18] హైడ్రోజన్ కంటే పెద్ద పరమాణువుల యొక్క నిర్మాణాత్మక, వర్ణపట నమూనాలు వంటి అంశాలలో మునుపటి నమూనాలు చేయలేని పరమాణువుల ప్రవర్తన యొక్క పరిశీలనలను ఈ నమూనా వివరించగలిగింది. అందువల్ల, పరమాణువు యొక్క గ్రహ మండల నమూనా కేంద్రకం చుట్టూ పరమాణు కక్ష్య మండలాలను వివరించే ఒకదానికి అనుకూలంగా విస్మరించబడింది, ఇక్కడ ఇచ్చిన ఎలక్ట్రాన్ ఎక్కువగా గమనించబడుతుంది.
న్యూట్రాన్ ఆవిష్కరణ
[మార్చు]మాస్ స్పెక్ట్రోమీటర్ యొక్క అభివృద్ధి పెరిగిన పరమాణువుల ద్రవ్యరాశిని ఖచ్చితత్వంతో కొలవడానికి అనుమతించింది. అయాన్ల పుంజం యొక్క పథాన్ని విచలనం చెందించడానికి ఈ పరికరంలో ఒక అయస్కాంతం ఉంటుంది. విక్షేపం మొత్తం పరమాణువు యొక్క ద్రవ్యరాశి, ఆవేశం యొక్క నిష్పత్తి ద్వారా నిర్ణయించబడుతుంది. రసాయన శాస్త్రవేత్త ఫ్రాన్సిస్ విలియం ఆస్టన్ ఐసోటోపులు వేర్వేరు ద్రవ్యరాశిని కలిగి ఉన్నాయని చూపించడానికి ఈ పరికరాన్ని ఉపయోగించాడు. ఈ ఐసోటోపుల యొక్క పరమాణు ద్రవ్యరాశి పూర్ణాంక మొత్తాలతో మారుతుంది, దీనిని పూర్ణాంక సంఖ్య నియమం అంటారు. ఈ విభిన్న ఐసోటోపుల యొక్క వివరణ 1932 లో భౌతిక శాస్త్రవేత్త జేమ్స్ చాడ్విక్ చేత ప్రోటాన్ మాదిరిగానే ద్రవ్యరాశి కలిగిన విద్యుదావేశం లేని కణమైన న్యూట్రాన్ ఆవిష్కరణకు దారి తీసింది. ఐసోటోపులను ఒకే సంఖ్యలో ప్రోటాన్లతో మూలకాలుగా వివరించాడు. కానీ పరమాణు కేంద్రకాలలో వేర్వేరు సంఖ్యలో న్యూట్రాన్లు ఉంటాయి.
కేంద్రక విచ్ఛిత్తి, అధిక-శక్తి భౌతిక శాస్త్రం
[మార్చు]1938 లో రూధర్ ఫర్డు విధార్థి అయిన జర్మన్ రసాయన శాస్త్రవేత్త ఒట్టో హాన్,, ట్రాన్స్ యురేనియం మూలకాలను పొందాలని ఆశిస్తూ యురేనియం పరమాణువులపై న్యూట్రాన్లను తాడనం చేసాడు. అతను కనుగొనదలచిన దానికి బదులుగా అతని రసాయన ప్రయోగాలు బేరియంను ఒక ఉత్పత్తిగా చూపించాయి. ఒక సంవత్సరం తరువాత, లిన్ మీట్నర్, ఆమె మేనల్లుడు ఒట్టో ఫ్రిష్ హాన్ ప్రయోగాల ఫలితంగా ఇది మొదటి ప్రయోగాత్మక పరమాణు విచ్ఛిత్తి అని ధృవీకరించారు. 1944 లో, హాన్ రసాయనశాస్త్రంలో నోబెల్ బహుమతిని అందుకున్నాడు. హాన్ ప్రయత్నాలు చేసినప్పటికీ, మీట్నర్, ఫ్రిస్చ్ యొక్క సేవలు గుర్తించబడలేదు.
1950 లలో, మెరుగైన కణాల త్వరణకాలను, కణ డిటెక్టర్ల అభివృద్ధి శాస్త్రవేత్తలు అధిక శక్తుల వద్ద కదిలే పరమాణువుల ప్రభావాలను అధ్యయనం చేయడానికి అనుమతించింది. న్యూట్రాన్లు, ప్రోటాన్లు హడ్రాన్లు లేదా క్వార్క్స్ అని పిలువబడే చిన్న కణాల మిశ్రమంగా కనుగొనబడ్డాయి. కణ భౌతిక శాస్త్రం యొక్క ప్రామాణిక నమూనా అభివృద్ధి చేయబడింది. ఈ ఉప-పరమాణు కణాల పరంగా కేంద్రకం యొక్క లక్షణాలను, వాటి పరస్పర చర్యలను నియంత్రించే శక్తులను ఇప్పటివరకు విజయవంతంగా వివరించారు.
నిర్మాణం
[మార్చు]ఉప పరమాణు కణాలు
[మార్చు]పరమాణువు (ఆటం) అనే పదం మొదట చిన్న కణాలుగా విభజించలేని కణంగా సూచిస్తున్నప్పటికీ, ఆధునిక శాస్త్రీయ వాడుకలో పరమాణువు వివిధ ఉప పరమాణు కణాలను కూడి ఉంటుంది. ఒక పరమాణువు లోని ఎలక్ట్రాన్, ప్రోటాన్, న్యూట్రాన్ .
ఎలక్ట్రాన్ 9.11×10−31 కి.g ద్రవ్యరాశి కలిగి ఉంటుంది. ఇది ఋణావేశాన్ని కలిగి ఉంటుంది. అందుబాటులో ఉన్న పద్ధతులతో కొలవడానికి దీని పరిమాణం చాలా చిన్నదిగా ఉంటుంది.[19] న్యూట్రినో ద్రవ్యరాశిని కనుగొనే వరకు ఇది పరమాణువులో మిగిలిన ధనాత్మక ద్రవ్యరాశిని కొలిచే తేలికైన కణం. సాధారణ పరిస్థితులలో, ఎలక్ట్రాన్లు వ్యతిరేక విద్యుత్ ఆవేశాల నుండి సృష్టించబడిన ఆకర్షణ ద్వారా ధనావేశ కేంద్రకానికి ఆకర్షించబడి ఉంటాయి. ఒక పరమాణువు దాని పరమాణు సంఖ్య కంటే ఎక్కువ లేదా తక్కువ ఎలక్ట్రాన్లను కలిగి ఉంటే, అది వరుసగా ధనాత్మక లేదా ఋణాత్మక ఆవేశం అవుతుంది; ఆవేశం కలిగి ఉన్న పరమాణువును అయాన్ అంటారు. 19 వ శతాబ్దం చివరి నుండి ఎలక్ట్రాన్లు ప్రసిద్ధి చెందాయి, దీని ఆవిష్కరణలో ఎక్కువగా కృషిచేసిన జెజె థామ్సన్కు కృతజ్ఞతలు;
ప్రోటాన్లు 1.6726×10−27 కి.g ద్రవ్యరాశి కలిగి ఎలక్ట్రాన్ ద్రవ్యరాశి కంటే 1836 రెట్లు కలిగి ఉంటుంది. ఇది ధనావేశ కణం. పరమాణువులో ప్రోటాన్ల సంఖ్యను పరమాణు సంఖ్య అంటారు. ఎర్నెస్ట్ రూథర్ఫోర్డ్ (1919), ఆల్ఫా-కణాల తాడనం చేసిన తరువాత నత్రజని హైడ్రోజన్ కేంద్రకాలుగా ఏర్పడటాన్ని గమనించాడు. 1920 నాటికి హైడ్రోజన్ కేంద్రకం పరమాణువులోని ఒక ప్రత్యేకమైన కణమని అంగీకరించి దానికి ప్రోటాన్ అని పేరు పెట్టారు.
న్యూట్రాన్లకు విద్యుత్ ఆవేశం ఉండదు. ఇవి తటస్థ ఆవేశాన్ని కలిగి ఉంటాయి. దీని ద్రవ్యరాశి ఎలక్ట్రాన్ ద్రవ్యరాశికి 1839 రెట్లు ఉంటుంది. దీని ద్రవ్యరాశి 1.6749×10−27 కి.g.[20][21] పరమాణువులోని ముఖ్యమైన మూడు మౌలిక కణాలలో న్యూట్రాన్లు ఎక్కువ ద్రవ్యరాశి కలిగి ఉంటాయి. అయితే వాటి ద్రవ్యరాశిని కేంద్రక బంధన శక్తి ద్వారా తగ్గించవచ్చు. న్యూట్రాన్లు, ప్రోటాన్లు (సమష్టిగా కేంద్రక కణాలు అని పిలుస్తారు) 'ఉపరితలం' షార్ప్ గా ఉండదని నిర్వచించబడనప్పటికీ 2.5×10−15 మీ. క్రమంలో పోల్చదగిన కొలతలు కలిగి ఉంటాయి.[22] న్యూట్రాన్ ను 1932 లో ఆంగ్ల భౌతిక శాస్త్రవేత్త జేమ్స్ చాడ్విక్ కనుగొన్నాడు .
భౌతిక శాస్త్రంలోని ప్రామాణిక నమూనాలో ఎలక్ట్రాన్లు నిజంగా అంతర్గత నిర్మాణం లేని ప్రాథమిక కణాలు, అయితే ప్రోటాన్లు, న్యూట్రాన్లు క్వార్క్స్ అని పిలువబడే ప్రాథమిక కణాలతో కూడిన మిశ్రమ కణాలు. పరమాణువులో రెండు రకాల క్వార్క్లు ఉన్నాయి. ప్రతి ఒక్కటి భాగాలుగా విద్యుత్ ఆవేశాన్ని కలిగి ఉంటాయి. ప్రోటాన్లు రెండు అప్ క్వార్క్స్ (ప్రదీదీ +2/3 ఆవేశం ), ఒక డౌన్ క్వార్క్ ( −1/3 ఆవేశం) తో తయారవుతాయి. న్యూట్రాన్లు ఒక అప్ క్వార్క్, రెండు డౌన్ క్వార్క్లను కలిగి ఉంటాయి. ఈ వ్యత్యాసం రెండు కణాల మధ్య ద్రవ్యరాశి, ఆవేశాలలో వ్యత్యాసానికి కారణమవుతుంది.
క్వార్క్లు బలమైన పరస్పర చర్య (లేదా బలమైన శక్తి) ద్వారా కలిసి ఉంటాయి. ఇది గ్లూన్లచే కలిసి ఉంటాయి. ప్రోటాన్లు, న్యూట్రాన్లు, పరమాణు కేంద్రకంలో ఒకదానికొకటి కేంద్రక శక్తి చేత బంధించబడి ఉంటాయి.
పరమాణు కేంద్రకం
[మార్చు]
పరమాణువులోని అన్ని బంధించబడి ఉన్న ప్రోటాన్లు, న్యూట్రాన్లు ఒక చిన్న పరమాణు కేంద్రకాన్ని తయారు చేస్తాయి. వాటిని సమష్టిగా న్యూక్లియోన్లు (కేంద్రక కణాలు) అంటారు. కేంద్రకం యొక్క వ్యాసార్థం సుమారు 1.07 3√A fm ఉంటుంది. ఇక్కడ మాణువు యొక్క వ్యాసార్థం 105 fm కంటే చాలా చిన్నది. కేంద్రక కణాలు అవశేష బలమైన శక్తి అని పిలువబడే స్వల్ప-శ్రేణి ఆకర్షణీయమైన శక్తితో కలసి ఉంటాయి. 2.5 ఎఫ్ఎమ్ కంటే తక్కువ దూరంలో ఉన్నప్పుడు ఈ శక్తి స్థిర విద్యుదాకర్షణ బలం కంటే చాలా శక్తివంతమైనది, ఇది ధనావేశం చేయబడిన ప్రోటాన్లు ఒకదానికొకటి వికర్షించడానికి కారణమవుతుంది.[23]
ఒకే మూలకం యొక్క పరమాణువులకు ఒకే సంఖ్యలో ప్రోటాన్లు ఉంటాయి. వీటిని పరమాణు సంఖ్య అంటారు. ఒకే మూలకంలో, న్యూట్రాన్ల సంఖ్య మారవచ్చు. అపుడు ఆ మూలకం యొక్క ఐసోటోప్ను ఏర్పడతాయి. ప్రోటాన్లు, న్యూట్రాన్లు మొత్తం సంఖ్య నూక్లైడ్ ను గుర్తిస్తుంది. ప్రోటాన్లకు సంబంధించి న్యూట్రాన్ల సంఖ్య కేంద్రకం యొక్క స్థిరత్వాన్ని నిర్ణయిస్తుంది. కొన్ని ఐసోటోపులు రేడియోధార్మిక విఘటనానికి గురవుతాయి .
ప్రోటాన్, ఎలక్ట్రాన్, న్యూట్రాన్లను ఫెర్మియాన్లుగా వర్గీకరించారు. ఫెర్మియాన్లు పౌలీ వర్జన నియమాన్ని పాటిస్తాయి. అందువల్ల కేంద్రకంలోని ప్రతీ ప్రోటాన్ అన్ని ఇతర ప్రోటాన్ల నుండి భిన్నమైన క్వాంటం స్థితిని ఆక్రమించాలి. కేంద్రకం యొక్క అన్ని న్యూట్రాన్లకు, ఎలక్ట్రాన్ మేఘం యొక్క అన్ని ఎలక్ట్రాన్లకు ఇది వర్తిస్తుంది.[24]
గమనికలు
[మార్చు]- ↑ Iron(II) oxide's formula is written here as Fe2O2 rather than the more conventional FeO because this better illustrates the explanation.
మూలాలు
[మార్చు]- ↑ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. pp. 31–33. ISBN 978-0-19-515040-7.
- ↑ Melsen (1952). From Atomos to Atom, pp. 18-19
- ↑ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 36
- ↑ Melsen (1952). From Atomos to Atom, p. 137
- ↑ Dalton (1817). A New System of Chemical Philosophy vol. 2, pp. 28
- ↑ Millington (1906). John Dalton, p. 113
- ↑ Dalton (1808). A New System of Chemical Philosophy vol. 1, pp. 316-319
- ↑ Holbrow et al (2010). Modern Introductory Physics, pp. 65-66
- ↑ Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. pp. 1–7. ISBN 978-0-19-851567-8. OCLC 48753074.
- ↑ Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. pp. 1–7. ISBN 978-0-19-851567-8. OCLC 48753074.
- ↑ Thomson, J.J. (August 1901). "On bodies smaller than atoms". The Popular Science Monthly: 323–335. Retrieved 2009-06-21.
- ↑ Navarro (2012). A History of the Electron, p. 94
- ↑ 13.0 13.1 Heilbron (2003). Ernest Rutheford and the Explosion of Atoms, pp. 64-68
- ↑ 14.0 14.1 14.2 Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. pp. 228–230. ISBN 978-0-19-851971-3.
- ↑ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. pp. 205–226. ISBN 978-0-19-530573-9.
- ↑ McEvoy, J. P.; Zarate, Oscar (2004). Introducing Quantum Theory. Totem Books. pp. 110–114. ISBN 978-1-84046-577-8.
- ↑ Kozłowski, Miroslaw (2019). "The Schrödinger equation A History".
- ↑ Chad Orzel (16 September 2014). "What is the Heisenberg Uncertainty Principle?". TED-Ed. Archived from the original on 13 September 2015 – via YouTube.
- ↑ Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer. pp. 39–42. ISBN 978-3-540-20631-6. OCLC 181435713.
- ↑ Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. p. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- ↑ Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), "The 2014 CODATA Recommended Values of the Fundamental Physical Constants" Archived 2012-02-11 at the Wayback Machine (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ↑ MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. pp. 33–37. ISBN 978-0-19-521833-6. OCLC 223372888.
- ↑ Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. pp. 330–336. ISBN 978-1-86094-250-1. OCLC 45900880.
- ↑ Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. p. 63. ISBN 978-0-387-23284-3. OCLC 228384008.
- Oliver Manuel (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 978-0-306-46562-8. OCLC 228374906.
- Andrew G. van Melsen (2004) [1952]. From Atomos to Atom: The History of the Concept Atom. Translated by Henry J. Koren. Dover Publications. ISBN 0-486-49584-1.
- J.P. Millington (1906). John Dalton. J. M. Dent & Co. (London); E. P. Dutton & Co. (New York).
- Charles H. Holbrow; James N. Lloyd; Joseph C. Amato; Enrique Galvez; M. Elizabeth Parks (2010). Modern Introductory Physics. Springer Science & Business Media. ISBN 9780387790794.
- John Dalton (1808). A New System of Chemical Philosophy vol. 1.
- John Dalton (1817). A New System of Chemical Philosophy vol. 2.
- John L. Heilbron (2003). Ernest Rutherford and the Explosion of Atoms. Oxford University Press. ISBN 0-19-512378-6.
- Jaume Navarro (2012). A History of the Electron: J. J. and G. P. Thomson. Cambridge University Press. ISBN 9781107005228.
బాహ్య లింకులు
[మార్చు]- Sharp, Tim (8 August 2017). "What is an Atom?". Live Science.
- "Hitchhikers Guide to the Universe, Atoms and Atomic Structure". h2g2. BBC. 3 January 2006.