పాదరసము
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| పాదరసం | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | silvery | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Hg) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| పాదరసం in the periodic table | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | మూస:Infobox element/symbol-to-group/format | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d10 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | liquid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 234.3210 K (−38.8290 °C, −37.8922 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 629.88 K (356.73 °C, 674.11 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 13.534 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 234.3156 K, 1.65×10−7 kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 1750 K, 172.00 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 2.29 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 59.11 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 27.983 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2 , +1, +2 (a mildly basic oxide) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 151 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 132±5 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | rhombohedral | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | (liquid, 20 °C) 1451.4 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 60.4 µm/(m⋅K) (at 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 8.30 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | (25 °C) 961n Ω⋅m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-97-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Ancient Chinese and Indians (before 2000 BC) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | "Hg": from its Latin name hydrargyrum, itself from Greek hydrárgyros, 'water-silver' | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes of పాదరసం | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Template:infobox పాదరసం isotopes does not exist | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

పాదరసం ఒక రసాయన మూలకము. దీని సంకేతము Hg, పరమాణు సంఖ్య 80. దీనిని క్విక్ సిల్వర్ అంటారు. దీని గ్రీక్ పేరు "హైడ్రార్జిరం" (/haɪˈdrɑːrdʒərəm/), "హైడ్రార్" అనే పదం నీల్లు అనే అర్థం తో మరియు "అర్జైరోస్" అనే పదం వెండి అనే అర్థం తో. [4] . ఇది ఆవర్తన పట్టికలో "డి" బ్లాకుకు చెందిన మూలకం. ఇది సాధారణ ఉష్ణోగ్రత, పీడనాల వద్ద ద్రవరూపంలో ఉండే ఏకైక లోహం. ఇదే పరిస్థితులలో ద్రవరూపంలో ఉండే మూలకం బ్రోమిన్. గది ఉష్ణోగ్రత కంటే కొద్దిగా ఎక్కువ ఉష్ణోగ్రత వద్ద సీజియం, గాలియం, రుబీడియం మూలకాలు ద్రవరూపంలోనికి మారుతాయి.
పాదరసం ప్రకృతిలో "సిన్నాబార్ (మెర్క్యురిక్ సల్ఫైడ్)" రూపంలో ఖనిజంగా లభ్యమవుతుంది.
పాదరసం ధర్మోమీటర్లు, బారోమీటర్లు, మానోమీటర్లు, స్పైగ్మో మానోమీటర్లు, తేలియాడే కవాటాలు (ఫ్లోట్ వాల్వులు), మెర్క్యురీ స్విచ్లు, మెర్క్యురీ రిలేస్, ఫ్లోర్సెంట్ దీపాలు, యితర పరికరాలలో ఉపయోగిస్తారు. పాదరసం మూలకం విషతుల్యం అయినందున దీనిని ధర్మోమీటర్లు, స్పైగ్మోమానోమీటర్లలో వైద్యరంగంలో వినియోగించడం తగ్గించారు. దీని స్థానంలో ఆల్కహాల్ లేదా గాలిన్స్టన్ తో నింపబడిన గాజు ధర్మోమీటర్లను, ధర్మిస్టర్ లేదా పరారుణ ఆధారిత ఎలక్ట్రానిక్ పరికరాలను వినియోగిస్తున్నారు. అదే విధంగా మెర్క్యురీ స్పైగ్మోమీటర్ల స్థానంలో మెకానికల్ ప్రెజర్ గేజ్, ఎలక్ట్రానికి స్ట్రయిన్ గేజ్ లు వాడుకలోనికి వచ్చాయి. పాదరసాన్ని శాస్త్రీయ పరిశోధనలలో, దంతవైద్యంలో "అమాల్గం" గాను ఉపయోగిస్తున్నారు. పాదరసాన్ని మెర్క్యురీ ప్లోర్సెంట్ దీపాలకు ఉపయోగిస్తారు. పాదరస బాష్పాల నుండి విద్యుత్ ప్రసరించినపుడు తక్కువ తరంగదైర్ఘ్యం గల అతినీలలోహిత కాంతి వెలువడుతుంది. దీని కారణంగా గొట్టం ప్రకాశవంతమై దృగ్గోచర కాంతి ఉత్పత్తి అవుతుంది.
నీటిలోకరిగే పాదరస విషతుల్యాలు (ఉదా: మెర్యురిక్ క్లోరైడ్ లేదా మిథైల్ మెర్క్యురీ), పాదరస భాస్ఫాలను పీల్చడం కారణంగా కారణంగా పాదరస విషమయం అవుతుంది.
ధర్మములు
[మార్చు]భౌతిక ధర్మములు
[మార్చు]
పాదరసం భారమైన, వెండి-తెలుపు రంగు గల ద్రవరూప లోహం. ఇతర లోహాలలో పోల్చినపుడు తక్కువ ఉష్ణవాహకత కలిగి ఉంటుంది కానీ మంచి విద్యుద్వాహకం.[5]
దీని ఘనీభవన స్థానం −38.83 °C, బాష్పీభవన స్థానం 356.73 °C, [6][7][8]. ఈ విలువలు ఏవైనా స్థిర లోహాల కంటే తక్కువ.[9] పాదరసాన్ని ఘనీభవనం చెందించినపుడు దాని ఘనపరిమాణం 3.59% తగ్గుతుంది, సాధ్రత 13.69 g/cm3 (ద్రవరూపంలో ఉన్నప్పుడు) నుండి 14.184 g/cm3 (ఘన రూపంలో ఉన్నప్పుడు) కు పెరుగుతుంది. ఘనపరిమాణ వ్యాకోచ గుణకం 0 °C వద్ద 181.59 × 10−6, 20 °C వద్ద 181.71 × 10−6, 100 °C వద్ద 182.50 × 10−6 ఉంటుంది. ఘన రూప పాదరసం స్తరణీయత, తాంతవత లక్షణాలను కలిగి ఉండి కత్తితో కత్తిరించే విధంగా ఉంటుంది.[10]
పాదరసం ఎలక్ట్రాన్ విన్యాసంలో ఎలక్ట్రానులు 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 6s ఉప స్థిర కక్ష్యలలో ఉంటాయి. ఈ విన్యాసం ఎలక్ట్రాన్ కోల్పోవడాన్ని నిరోధిస్తుంది కనుక పాదరసం జడ వాయువుల వలె ప్రవర్తిస్తుంది. బలహీన బంధాలను ఏర్పరచుకోవడం వలన దీని ద్రవీభవన ఉష్ణోగ్రత తక్కువగా ఉంటుంది.
రసాయన ధర్మములు
[మార్చు]పాదరసం, సజల సల్ఫ్యూరికామ్లం వంటి అనేక ఆమ్లాలతో చర్య జరపదు. కానీ గాఢ సల్ఫ్యూరికామ్లం, నత్రికామ్లము లేదా ఆక్వా రెజియా వంటి ఆక్సీకరణ ఆమ్లాలలో కరిగి సల్ఫేట్, నైట్రేట్, క్లోరైడ్లను ఇస్తుంది. సిల్వర్ (వెండి) వలెనే పాదరసం వాతావరణంలోని హైడ్రోజన్ సల్ఫైడ్ తో చర్యజరుపుతుంది. పాదరసం ఘన రూప గంధకం (సల్ఫర్) తో చర్య జరుపుతుంది.[11]
అమాల్గములు
[మార్చు]
పాదరసం బంగారం, వెండి వంటి లోహాలలో కరిగి వాటి అమాల్గములను ఏర్పరచును. ఇందులో ఇనుము మినహాయింపు. ఇనుప పాత్రలను పాదరసం సాంప్రదాయకంగా పాదరసం వర్తకంలో వాడుతారు. ఆవర్తన పట్టికలోని మొదటి వరుసలోని ఇతర పరివర్తన మూలకాలలో మాగనీస్, కాపర్, జింక్ లు అమాల్గములు ఏర్పరచడానికి అయిష్టతను చూపుతాయి. ప్లాటినంతో సహా యితర మూలకాలు పాదరసంతో అమాల్గములు ఏర్పరచవు.[12][13] సేంద్రియ సంశ్లేషణలో సాధారణంగా సోడియం అమాల్గములు క్షయకరణ కారకాలుగా పనిచేస్తాయి. ఈ అమాల్గములు అధిక పీడన సోడియం దీపాలలో వాడుతారు.
స్వచ్ఛమైన పాదరసం అల్యూమినియం మూలకాలు కలసినపుడు మెర్క్యురీ - అల్యూమినియం అమాల్గం ఏర్పరచును. ఈ అమాల్గం అల్యూమినియం లోహాన్ని అల్యూమినియం ఆక్సైడ్ పొర ఏర్పడుటను (క్షయం కాకుండా) కాపాడుతుంది. అయినప్పటికీ కొద్ది మొత్తంలో పాదరసం అల్యూమినియాన్ని క్షయం చెందిస్తుంది. దీని కారణంగా సాధారణ పరిస్థితులలో విమానాలలో పాదరసం అనుమతించబడదు. ఎందుకంటే విమానం యొక్క బహిర్గత అల్యూమినియం భాగాలతో పాదరసం కలసి మిశ్రమాన్ని ఏర్పరుస్తుంది.[14]
పాక్షిక పరిస్థితులలో ఒక విమానంలో పాదరసం అనుమతించబడదు ఎందుకంటే ఇది విమానంలో బహిర్గతమైన అల్యూమినియం భాగాలతో ఒక మిశ్రమాన్ని ఏర్పరుస్తుంది. పాదరసం పెళుసుదనం ద్రవలోహాల పెళుసుదనం యొక్క సాధారణ రకం.
ఐసోటోపులు
[మార్చు]పాదరసానికి అనేక స్థిర ఐసోటోపులు ఉన్నాయి. అందులో అత్యధికంగా (29.86%) లభ్యమయ్యేది 202
Hg. ఎక్కువ కాలం జీవించే రేడియో ఐసోటోపులు 194
Hg (అర్థ జీవిత కాలం 444 సంవత్సరాలు), 203
Hg (అర్థ జీవిత కాలం 46.612 రోజులు). మిగిలిన ఐసోటోపులలో అనేకమైన వాటి అర్థ జీవిత కాలం ఒక రోజు కంటే తక్కువ ఉంటుంది. 199
Hg, 201
Hg లను తరచుగా NMR (నూక్లియర్ మాగ్నటిక్ రిజొనెన్స్) - క్రియాశీల కేంద్రకాలలో పరిశోధిస్తుంటారు. వీటి స్పిన్ లు వరుసగా ½, 3⁄2 ఉంటాయి.[5]
వ్యుత్పత్తి
[మార్చు]పాదరసం యొక్క నవీన రసాయన సంకేతం Hg. ఈ పదం లాటిన్ పదమైన "హైడ్రార్జిరం" నుండి వ్యుత్పత్తి అయినది. ఈ పదం యొక్క అర్థం "వాటర్-సిల్వర్". ఈ పదార్థం నీరువలె ఉండి వెండిని పోలి ఉండటం వలన ఈ పేరు వచ్చింది. వేగం, చలనశీలత కలిగిన రోమన్ దేవుడైన "మెర్క్యురి" పేరును ఈ మూలకానికి పెట్టారు. ఈ మూలకం పేరు సౌరమండలంలోని మెర్క్యురీ (బుధుడు) తో సంబంధం కలిగి లోహం యొక్క రసవాద సంకేతాలతో కూడా పోలి ఉంటుంది. రసవిజ్ఞానం యొక్క సంస్కృత అర్థం "రసవతం". దీని అర్థం "ద వే ఆఫ్ మెర్క్యురీ".[15]
చరిత్ర
[మార్చు]
పాదరసం సా.శ.పూ 1500 నుండి ఈజిప్టు సమాధులపై కనుగొన్నారు.[16]
చైనా, టిబెట్ లలో జీవితకాలం పోడిగించుకోవడానికి, పగుళ్ళు నయం చేయడానికి, ఆరోగ్యాన్ని కాపాడుకోవడానికి ఉపయోగించేవారు. అయితే పాదరసం ఆవిరికి గురికావడం తీవ్రమైన ప్రతికూల ఆరోగ్య ప్రభావాలు కలిగాయి.[17] చైనా మొదటి చక్రవర్తి అయిన "క్విన్ షి హాంగ్ డి" తాను పరిపాలిస్తున్న రాజ్యంలో ప్రవహిస్తున్న పాదరసం గల నదిలో ఉన్న సమాధిలో ఖననం చేయబడ్డాడు అనే ఆరోపణలున్నాయి. అతడికి అమరత్వం ప్రసాదించుటకు క్విన్ దేశ రసవాదులచే (కాలేయం వైఫల్యం, పాదరస విషమయం, మెడడు చావు కారణంగా) పాదరసం త్రావింపబడి మరణించాడని ఆరోపణలున్నాయి.[18][19]
ఈజిప్టు లోని రెండవ తులునిడ్ పాలకుడు "ఖుమరవేహ్ ఇబ్న్ అహ్మద్ ఇబ్న్ తులున్" (884-896) దుబారా, వృధావ్యయం చేసేవానిగా పేరు పొందాడు. అతడు పాదరసంతో నింపిన ఒక తొట్టెలో గాలితో నింపిన తలగడలపై నిద్రించేవాడు.[20]
2014 నవంబరులో అధిక పరిమాణంలో గల పాదరస నిల్వలను మెక్సికోలోని 1800 సంవత్సరాల నాటి "టెంపుల్ ఆఫ్ ద ఫీచర్డ్ సెర్పంట్" పిరమిడ్ 60 అడుగుల క్రిందిభాగంలో గల గదిలో విగ్రహాలు, చిరుతపులి అవశేషాలతో గల పెట్టెలో కనుగొన్నారు.[21]
ప్రాచీన గ్రీకులు సిన్నాబార్ (మెర్క్యురి సల్ఫైడ్) ను లేపనాలకు వాడేవారు. ప్రాచీన ఈజిప్టియన్లు, రోమన్లు సౌందర్య సాధన సామాగ్రికి ఉపయోగించేవారు. మయ నాగరికతలో పెద్ద నగరంగా ఉండే లామనాయిలో గల మెసమెరిచన్ బాల్కోర్టులో పాదరస కొలనును కనుగొన్నారు.[22][23]
సా.శ.పూ 500 లలో ఇతర లోహాలతో కూడిన "అమాల్గం" (పాదరసం యొక్క మిశ్రమలోహాలు) లను తయారుచేయబడ్డాయి.[24]
రసవాదుల ఆలోచన ప్రకారం అన్ని లోహాలు ఏర్పడటానికి మొట్టమొదటి పదార్థంగా పాదరసం ఉండేది. పాదరసంలో సల్ఫర్ వివిధ పరిమాణంలో చేరడం వలన వివిధ లోహాలు ఏర్పడ్డాయని నమ్మేవారు. ఈ సమ్మేళనాలలో స్వచ్ఛమైనది బంగారం అని వారి నమ్మకం.[25]
ఆల్మడెన్ (స్పెయిన్), మోంటే అమియాటా (ఇటలీ), ఇద్రిజ (ప్రస్తుతం సాల్వేనియా) గనులలో అధిక స్థాయిలో పాదరసం లభ్యమవుతుంది. 2500 సంవత్సరాలకు పూర్వం అమాల్డన్ గనులు ప్రారంభమైనవి. 19వ శతాబ్దం చివరివరకు కొత్త నిల్వలు కనుగొనబడ్డాయి.[26]
లభ్యత
[మార్చు]పాదరసం భూ పటలంలో లభ్యమయ్యే అరుదైన మూలకం. భూ పటలంలో మిలియన్ భాగాలలో 0.08 భాగాలు ద్రవ్యరాశి పరంగా లభ్యమవుతుంది.[27] పాదరసం భూపటలంలో అత్యధికంగా గల మూలకాలతో చర్య చెందదు. పాదరస ధాతువులు సాధారణమైన రాతిలో మూలకం సమృద్ధిగా అసాధారణమైన గాఢతతోలభ్యమవుతుంది. అత్యధిక పరిమాణంలో గల పాదరస ధాతువులు ద్రవ్యరాశి పరంగా 2.5% పాదరసాన్ని కలిగి ఉంటాయి. అతి తక్కువగా పాదరస ధాతువులు 0.1% పాదరసాన్ని కలిగి ఉంటాయి. పాదరసం ప్రకృతిసిద్ధం లోహంగా (అరుదుగా) లేదా సిన్నాబార్, కార్డెరోయిట్, లివింగ్స్టోనైట్, ఇతర ఖనిజాలలో లభ్యవవుతుంది. పాదరసం యొక్క సాధారణ ఖనిజం "సిన్నాబార్" (HgS) [28] పాదరస ఖనిజాలు తరచుగా వేడి నీటి బుగ్గలు లేదా ఇతర అగ్నిపర్వత ప్రాంతాలలో ఉంటాయి.[29]
1558 ప్రారంభంలో ధాతువు నుండి వెండిని పాదరసం ఉపయోగించి సంగ్రహణం చేయుటకు "పాటియో విధానం" కనుగొనబడింది. దీని కారణంగా స్పెయిన్, దానిలోగల అమరికన్ కాలనీల ఆర్థిక వ్యవస్థలో పాదరసం ఆవశ్యక వనరుగా పరిగణింపబడేది. న్యూ స్పెయిన్, పెరూ దేశాలలో లూక్రటివ్ గనుల నుండి సిల్వర్ ను సంగ్రహించుటకు పాదరసాన్ని ఉపయోగించేవారు. ప్రారంభంలో దక్షిణ స్పెయిన్ లోని ఆలమండెన్ వద్ద గల స్పానిష్ క్రౌన్ గనులు పాదరసాన్ని అన్ని కాలనీలకు సరఫరా చేసేవి.[30] నవీన ప్రపంచంలో మూడు శతాబ్దాలలో 100,00 టన్నుల పాదరసాన్ని హకావెలికా, పెరూ ప్రాంతాలలో గల గనుల నుండి తీసారు. 19 వ శతాబ్దంలో పాదరసాన్ని వెండి గనులలో ఉపయోగించుటకు పాటియో పద్ధతి, తరువాత పాన్ అమాల్గమేషన్ పద్ధతులకు అధిక డిమాండ్ ఉంది.[31]
ఇటలీ, యునైటెడ్ స్టేట్స్, మెక్సికో దేశాలలోని పూర్వపు గనులు, ప్రపంచంలో అధిక పరిమాణంలో పాదరసాన్ని ఉత్పత్తి చేసేవి. ప్రస్తుతం అవి పూర్తిగా మైనింగ్ చేయబడినవి. అదే విధంగా స్లోవేనియా (ఇద్రజ), స్పెయిన్ (అల్మడెన్) గనులు పాదరసం ధర తగ్గిపోవడం కారణంగా మూసివేయబడినవి. 1992 లో యునైటెడ్ స్టేట్స్ లో వెవాడా యొక్క మెక్డెర్మిట్ గని మూసివేయబడింది. పాదరసం యొక్క ధర వివిధ సంవత్సరాలలో చాలా అస్థిరంగా ఉంది. 2006 లో 76 పౌండ్ల (34.46 kg) ఫ్లాస్కుకు $ 650 ఉంది.[32]

పాదరస ధాతువైన "సిన్నాబార్"ను గాలిలో వేడి చేయడం , దాని ఆవిర్లను ద్రవీకరించడం వలన సంగ్రహణం చేస్తారు. ఈ చర్యకు రసాయన సమీకరణం.
- HgS + O2 → Hg + SO2
2005లో ప్రపంచ పాదరస ఉత్పత్తిలో మూడింట రెండు వంతులు చైనా మొదటి స్థానంలో ఉంది.[33] అనేక ఇతర దేశాలలో కూడా కాపర్ ఎలక్ట్రోవిన్నిగ్ పద్ధతులు , వ్యర్థాల నుండి పాదరసం నమోదు కాబడిన స్థాయిలో ఉత్పత్తి అయినట్లు భావింపబతుతోంది.
పాదరసం అధిక విషతుల్యం అయినందున, సిన్నాబార్ను గనులనుండి త్రవ్వకాలు , పాదరసం శుద్ధి విధానాలు ప్రమాదకరమైనవి , పాదరస విష కాలుష్యానికి చారిత్రిక కారణం అవుతున్నవి.[34] చైనాలో జైలులో గల ఖైదీ కార్మికులను 1950లలో సిన్నాబార్ మైనింగ్ అభివృద్ధి చేయడానికి ఉపయోగించేవారు. లుయో క్సై మైనింగ్ కంపెనీ ద్వారా క్రొత్త టన్నల్స్ నెలకొల్పుటకు వేలాది ఖైదీలను ఉపయోగించేవారు.[35] ఈ ఖనిజాన్ని త్రవ్వడానికి కూలీల ఆరోగ్యం పెద్ద ప్రమాదంలో పడుతుంది.
యూరోపియన్ యూనియన్ "ఫ్లోర్సెంట్ బల్బు" ల తయారీలో పాదరస వినియోగాన్ని గుర్తిస్తూ 2012 లో చైనాకు సిన్నాబార్ గనులను తిరిగి తెరవ వలసినదిగా పిలుపునిచ్చాయి. దక్షిణ నగరాలైన ఫోషన్, గువాన్ఝో లలో పర్యావరణ ప్రమాదాలు ఒక సమస్యగా మారాయి.[35]
రసాయనశాస్త్రం
[మార్చు]పాదరసం ముఖ్యంగా I, II ఆక్సీకరణ స్థితులలో ఉంటుంది.
పాదరసం(I) సమ్మేళనలు
[మార్చు]తేలికైన ఇతర మూలకాలైన కాడ్మియం, జింకు వలె కాక పాదరసం సాధారణంగా సరళమైన స్థిరమైన లోహ-లోహ బంధాలను ఏర్పరచగలదు. పాదరసం (I) సమ్మేళనాలు డయా అయస్కాత పదార్థాలు. అవి Hg2+
2 డైమరిక్ కాటయాన్లను ఏర్పరుస్తాయి. క్లోరైడ్లు, నైట్రేట్లతో పాటు స్థిర ఉత్పన్నాలను ఏర్పరుస్తాయి.[36] మెర్క్యురీ (I) క్లోరైడ్ రంగులేని ఘన పదార్థం. ఇది "కలోమెల్" అని పిలువబడుతుంది. దీని ఫార్ములా Hg2Cl2.
మెర్క్యురీ (I) హైడ్రైడ్ రంగులేని వాయుపదార్థం దీని ఫార్ములా HgH.[37]
పాదరసం (II) సమ్మేళనాలు
[మార్చు]మెర్క్యురీ (II) అనునది ప్రకృతిలో లభించిన సర్వసాధారణమైన ఆక్సీకరణ స్థితి. నాలుగు పాదరసం యొక్క హాలైడ్లు తెలిసినవే. అవి టెట్రాహైడ్రల్ నిర్మాణాలను కలిగి ఉంటాయి. వాటిలో మెర్క్యురీ (II) క్లోరైడ్ అందరికీ సుపరిచితమైనది. ఇది తెలుపు రంగును కలిగి "ఉత్పతనం" త్వరగా చెందగలదు. HgCl2 సంయోజనీయ బంధాలను ఏర్పరచి టెట్రాహైడ్రల్ నిర్మాణం కలిగిఉంటుంది.
పాదరసం ఆక్సైడ్ లలో ముఖ్యమైన మెర్క్యురీ (II) ఆక్సైడ్. ఎక్కువ ఉష్ణోగ్రతల వద్ద లోహానికి గాలి తగిలేటట్టు చేసినప్పుడు ఇది ఏర్పడుతుంది. ఇది 400 °C వద్ద వేడి చేయడం ద్వారా తిరోగమన చర్య జరిగుతుంది. ఈ చర్యను స్వచ్ఛమైన ఆక్సిజన్ యొక్క ప్రారంభ సంశ్లేషణలో జోసెఫ్ ప్రిస్టిలీ ప్రదర్శించినట్లుగా తెలుస్తుంది.[11]
సున్నితమైన లోహంగా పాదరసం చాల్కొజన్లతో కలసి స్థిరమైన ఉత్పన్నాలను ఏర్పరస్తుంది. అందులో మెర్క్యురీ (II) సల్ఫైడ్ (HgS) ప్రకృతిలో "సిన్నాబార్" థాతువు రూపంలో లభ్యమవుతుంది. జికు సల్ఫైడ్ (ZnS) వలెనే HgS రెండు రూపాలలో స్పటికీకరణం చెందుతుంది. అవి ఎరుపు రంగు గల ఘనాకృతి, నలుపు రంగు గల జింకే బ్లెండ్ రూపం.[5] మెర్క్యురీ (II) సెలెనైడ్, మెర్క్యురీ (II) టెల్లూరైడ్ కూడా సుపరిచితములైన ఉత్పన్నాలే. ఇవే కాకుండా వాటి ఉత్పన్నాలైన మెర్క్యురీ కాడ్మియం టెల్లూరైడ్, మెర్క్యురీ జింక్ టెల్లూరైడ్ లు అర్థవాహకాలుగా పరారుణ శోధక పదార్థాలుగా ఉపయోగపడుతున్నాయి.[38]
మెర్క్యురీ ఫల్మినేట్ అనేది ఒక డిటనేటర్. దీనిని ప్రేలుడు పదార్థాలలో వాడుతున్నారు.[5]
అనువర్తనాలు
[మార్చు]
పాదరసాన్ని పారిశ్రామికంగా రసాయనాల ఉత్పత్తిలో ఉపయోగిస్తారు. విద్యుత్, ఎలక్ట్రానిక్ అనువర్తనాలలో కూడా ఉపయోగిస్తారు. దీనిని ఉష్ణమాపకాలలో అధిక ఉష్ణోగ్రతలను గణన చేయడానికి ఉపయోగిస్తారు. మెర్క్యురీ దీపాలలలో వాయు స్థితిలో ఉన్న పాదరసం ఉపయోగపడుతుంది. పాదరసానికి గల విషతుల్యత కారణంగా ఇతర అనువర్తనాలలో దీని వినియోగం తగ్గించి ప్రత్యామ్నాయ పద్ధతులను అనుసరిస్తున్నారు.[39]
వైద్యరంగంలో
[మార్చు]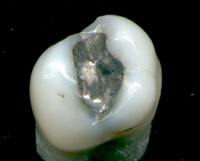
పాదరసం, దాని సమ్మేళనాలు వైద్యరంగంలో ఉపయోగపడుతున్నాయి. దంతాలకు వాడే అమాల్గంలో పాదరసం ముఖ్య అనుఘటకం. థియోమెర్సల్ అనే సేంద్రియ పదార్థం వాక్సిన్ లలో ఉపయోగిస్తున్నారు.[40] ఈ థియోమెర్సల్ అనేది ఇథైల్ మెర్క్యురీ యొక్క మెటబాలిక్ రూపం. ఈ పాదరస ఆధారిత పదార్థాల మూలంగా పిల్లల ఆరోగ్యానికి సష్టం వాటిల్లుతుందని విస్తృతంగా ప్రచారం జరిగింది. అయినప్పటికీ వీటికి ఆధారం చూపించడానికి శాస్త్రీయ అధ్యయనాలు లభ్యమవలేదు.[41] ఏదేమైనా, థియోమెర్సల్ 6 సంవత్సరాల వయస్సు, అంతకు తక్కువ గల పిల్లలకు వేసే టీకా మందుల నుండి తగ్గించబడింది లేదా తొలగించబడింది.[42]
మరొక పాదరస ఉత్పన్నం "మెర్బ్రోమిన్" ఆంటీసెప్టిక్ గా గాయాలు, పగుళ్ళకు కొన్ని దేశాలలో ఉపయోగిస్తున్నారు.
పాదరసం ముఖ్యంగా "సిన్నాబార్" అనే ముఖ్య ధాతువు నుండి లభ్యమవుతుంది. సిన్నాబార్ వివిధ రకాల మందులలో వాడుతారు. దీనిని సాంప్రదాయ చైనీయుల మందులలో వాడుతారు.[43]
నేడు, ఔషధంలో పాదరసం వినియోగం ముఖ్యంగా అన్ని దేశాలలో, ముఖ్యంగా అభివృద్ధి చెందిన దేశాలలో తగ్గింది. 18 వ శతాబ్దం, 19 వ శతాబ్దం చివరలో పాదరసాన్ని ఉపయోగించి పనిచేసే థర్మోమీటర్లు, స్పెగ్మోమానోమీటర్లు ఆవిష్కరించబడ్డాయి. 21వ శతాబ్ద ప్రారంభంలో పాదరస వినియోగాన్ని కొన్ని దేశాలు నిషేధించాయి. 2002లో యు.ఎస్. సెనేట్ పాదరస థర్మామీటర్లను దశల వారీగా విక్రయించుటను తగ్గించుట గూర్చి చట్టం చేసింది. 2003 లో, పాదరసం రక్తపోటు పరికరాలను నిషేధించడంలో అమెరికాలోని వాషింగ్టన్, మైనే రాష్ట్రాలు మొదటి రాష్ట్రాలు అయ్యాయి.[44]
పాదరస సమ్మేళనాలు వివిధ మందులు, ఆంటీసెప్టిక్స్, ఉత్తేజిత లాక్సేటివ్స్, డైపర్-రాష్-ఆయింటుమెంట్లు, కంటి చుక్కలు, ముక్కు స్ప్రేలలో కనుగొనవచ్చును.[45]
ప్రయోగశాల ఉపయోగాలు
[మార్చు]పాదరస థర్మోమీటర్లను అధిక ఉష్ణోగ్రతలను కనుగొనడానికి ఉపయొగిస్తారు. యునైటెడ్ స్టేట్స్ వీటి వినియోగాన్ని 2003 నుండి తగ్గించింది.[46]
పారరసం ద్రవరూప దర్పణ టెలిస్కోప్ లలో ఉపయోగిస్తారు.
ట్రాన్సిట్ టెలిస్కోపు లలో ఒక బేసిన్ లో పాదరసాన్ని నింపి సమతలంగా ఉండేటట్లు చేసి సమతల దర్పణంగా ఉపయోగిస్తారు. ఈ దర్పణాన్ని నిర్దేశిత చట్రంలో సమాంతర, లంబంగా ఉండే అంశాలను కనుగొనడానికి ఉపయోగిస్తారు. ఒక డిస్కులో పాదరసం తిరుగుతూ ఉండటం మూలంగా పుటాకార పరావలయ దర్పణాలు ఏర్పరచవచ్చును. ఈ దర్పణాలనుపయోగించి పరావర్తనం అయిన కాంతి కిరణాలను ఒక బిందువు వద్ద కేంద్రీకరింపబడేటట్లు చేయవచ్చును. ఈ టెలిస్కోపులు తక్కువ ధరలో లభ్యమవుతాయి.[47][48][49]
నిచే ఉపయోగం
[మార్చు]వాయు స్థితిలోఉన్న పాదరసాన్ని మెర్క్యురీ వేపర్ లాంపులలో ఉపయోగిస్తారు. దీనిని ప్లోర్సెంట్ దీపాలలో కూడా ఉపయోగిస్తారు. తక్కువ పీడనం కలిగిన దీపాల నుండి వర్ణపట రేఖలు సన్నగా ఉంటాయి. వీటిని సాంప్రదాయకంగా ఆప్టికల్ స్పెక్ట్రోగ్రఫీలో ఉపయోగిస్తారు. వాణిజ్య పరంగా ఈ దీపాలను ప్లోర్సెంట్ సీలింగ్ కాంతిని పరావర్తనం చెంది ప్రయోజనం కోసం విక్రయిస్తారు.[50]
-
పాదరస బాష్పం గాఢమైన వయోలెట్ రంగు కాంతిని "జెర్మిసిడల్ లేంప్" లలో ఉద్గారం చేస్తుంది.
-
తక్కువ పీడనం కలిగిన పాదరస బాష్ప లాంప్, రెండు పరారుణ దీపాలు.
-
ప్లోర్సెంట్ దీపాలు
విషతుల్యం , భద్రత
[మార్చు]మెర్క్యురీ, దాని సమ్మేళనాలు చాలా విషపూరితమైనవి, వాటితో మనం జాగ్రత్తలతో వ్యవహరించాలి; పాదరస వ్యర్థాల (థర్మోమీటర్లు లేదా ప్లోర్సెంట్ బల్బులలోనివి) వల్ల, పరిసరాలను కాలుష్యం జరగకుండా ఉండాలంటే వాటిని బహిరంగంగా యితర పదార్థాలతో కలియకుండా జాగ్రత్తలు తీసుకోవాలి.[51] విడి విడిగా బిందువుల వలె చెల్లాచెదురైన పాదరస వ్యర్థాలను కలిపి ఒకదగ్గరకు చేర్చి సులువుగా తొలగించవచ్చు. ఈ తొలగించిన పదార్థాన్ని డిస్పోజబుల్ పాత్రలో వేయాలి. వాక్యూమ్ క్లీనర్లు పాదరసం వ్యర్థాలను ఎక్కువ చెదరగొట్టడానికి కారణమవుతాయి కనుక వాటిని వాడకూడదు. పాదరసంతో సులువుగా కలసి అమాల్గంగా ఏర్పరచగల సల్ఫర్, జింకు లేదా యితర పౌడర్లను పాదరస వ్యర్థాలపై వేసి ఏర్పడిన పదార్థాన్ని సులువుగా తొలగించవచ్చు.
మెర్క్యూరీ చర్మం, శ్లేష్మ పొరల ద్వారా శోషించబడుతుంది, పాదరస ఆవిర్లు పీల్చడం కూడా ప్రమాదకరం కనుక పాదరస పాత్రలు సురక్షితంగా మూసివేసి ఉంచాలి. మెర్క్యూరీ దీర్ఘకాలికమైన, తీవ్రమైన విషప్రక్రియను కలిగించవచ్చు.
నియంత్రణలు
[మార్చు]అంతర్జాతీయం
[మార్చు]140 దేశాలు యునైటెడ్ నేషన్స్ ఎన్విరాన్మెంట్ ప్రోగ్రాం చే పాదరస ఉద్గారాలను తగ్గించాలనే ఒప్పందం చేసుకున్నాయి.[52] 2013 అక్టోబరు 10 న ఈ సమావేశం జరిగింది.[53]
అమెరికా సంయుక్త రాష్ట్రాలు
[మార్చు]యునైటెడ్ స్టేట్స్ లో, పర్యావరణ సంరక్షణ ఏజెన్సీ పాదరసం కాలుష్యం నియంత్రించేందుకు, నిర్వహించేందుకు అభియోగాలు చేసింది. అనేక చట్టాలు పర్యావరణ పరిరక్షణ కొరకు చేసింది. వాటిలో "క్లీన్ ఎయిర్ చట్టం", "క్లీన్ వాటర్ చట్టం", "రీసోర్స్ కన్సర్వేషన్ అండ్ రికవరీ ఆక్ట్", "సేఫ్ డ్రింకింగ్ వాటర్ చట్టం" ముఖ్యమైనవి. వీటికి అదనంగా 1996లో "మెర్క్యురీ కంటైనింగ్ అండ్ రీఛార్జబుల్ బ్యాటరీ మేనేజిమెంటు ఆక్ట్" ఆమోదించబడింది.[54] ఉత్తర అమెరికాలో 1995 లో మొత్తం ప్రపంచ మానవజన్య ఉద్గారాలలో దాదాపు 11% వాటా ఉంది.[55]
1990 లో ఆమోదించబడిన యునైటెడ్ స్టేట్స్ క్లీన్ ఎయిర్ ఆక్ట్, విషపూరిత కాలుష్యాల జాబితాలో పాదరసాన్ని చేర్చింది.
యూరోపియన్ యూనియన్
[మార్చు]యూరోపియన్ యూనియన్లో, ఎలక్ట్రికల్, ఎలక్ట్రానిక్స్ ఉత్పత్తుల్లో కొన్ని అపాయకరమైన పదార్ధాల యొక్క పరిమితిపై నిర్దేశించాయి. కొన్ని విద్యుత్, ఎలక్ట్రానిక్ ఉత్పత్తుల నుండి పాదరసం, ఇతర ఉత్పత్తుల్లో పాదరసం మొత్తం 1000 ppm కంటే తక్కువగా ఉండే విధంగా పరిమితం చేస్తుంది.[56] పాకేజింగ్, బ్యాటారీలలో పాదరసం గాఢతకు పరిమితులు ఉన్నాయి.[57] 2007 జూలై లో, యూరోపియన్ యూనియన్ కూడా థర్మామీటర్లు, భారమితి వంటి విద్యుత్ ఉపయోగించని గణన పరికరాలలో పాదరసం నిషేధించింది.[58]
నార్వే
[మార్చు]పాదరసం ఉత్పత్తుల తయారీ, దిగుమతి / ఎగుమతిలో పాదరస వినియోగాన్ని నార్వే 2008 జనవరి 1 నుండి పూర్తిగా నిషేధాన్ని అమలు చేసింది.[59] 2002 లో, నార్వేలోని అనేక సరస్సులు పాదరసం కాలుష్యం యొక్క పేలవమైన స్థితిని కలిగి ఉన్నాయి. వాటి అవక్షేపంలో 1 μg / g పాదరసం అధికంగా ఉంది.[60] 2008 లో నార్వే పర్యావరణ అభివృద్ధి శాఖ మంత్రి ఎరిక్ సోలహీం ఇలా అన్నాడు: "అత్యంత ప్రమాదకరమైన పర్యావరణ విషతుల్యాలలో పాదరసం ఒకటి. పాదరస ఉత్పత్తులకు సరిపడే సంతృప్తికరమైన ప్రత్యామ్నాయాలున్నందున వాటిని నిషేధించాలి. "[61]
స్వీడన్
[మార్చు]పాదరసం కలిగిన ఉత్పత్తులను స్వీడన్ 2009లో నిషేధించింది.[62][63]
డెన్మార్క్
[మార్చు]2008లో డెన్మార్క్ దేశం కూడా శాశ్వత (వయోజన) దంతాలలో మోలార్ మాలిస్టిక్ ఉపరితల పూరణలకు తప్ప పాదరస అమాల్గంలను నిషేధించింది.[61]
మూలాలు
[మార్చు]- ↑ "Standard Atomic Weights: Mercury". CIAAW. 2011.
- ↑ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; et al. (2022-05-04). "Standard atomic weights of the elements 2021 (IUPAC Technical Report)". Pure and Applied Chemistry (in ఇంగ్లీష్). doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ↑ "Magnetic susceptibility of the elements and inorganic compounds" in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ "hydrargyrum" Archived 12 ఆగస్టు 2014 at the Wayback Machine. Random House Webster's Unabridged Dictionary.
- ↑ 5.0 5.1 5.2 5.3 Hammond, C. R The Elements Archived 26 జూన్ 2008 at the Wayback Machine in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Senese, F. "Why is mercury a liquid at STP?". General Chemistry Online at Frostburg State University. Archived from the original on 4 ఏప్రిల్ 2007. Retrieved 1 ఏప్రిల్ 2018.
- ↑ Norrby, L.J. (1991). "Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?". Journal of Chemical Education. 68 (2): 110. Bibcode:1991JChEd..68..110N. doi:10.1021/ed068p110.
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. pp. 4.125–4.126. ISBN 0-8493-0486-5.
- ↑ "Dynamic Periodic Table". www.ptable.com. Archived from the original on 20 నవంబరు 2016. Retrieved 22 నవంబరు 2016.
- ↑ Simons, E. N. (1968). Guide to Uncommon Metals. Frederick Muller. p. 111.
- ↑ 11.0 11.1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Gmelin, Leopold (1852). Hand book of chemistry. Cavendish Society. pp. 103 (Na), 110 (W), 122 (Zn), 128 (Fe), 247 (Au), 338 (Pt). Archived from the original on 9 మే 2013. Retrieved 30 డిసెంబరు 2012.
- ↑ Soratur (2002). Essentials of Dental Materials. Jaypee Brothers Publishers. p. 14. ISBN 978-81-7179-989-3. Archived from the original on 3 జూన్ 2016.
- ↑ Vargel, C.; Jacques, M.; Schmidt, M. P. (2004). Corrosion of Aluminium. Elsevier. p. 158. ISBN 9780080444956.
- ↑ Cox, R (1997). The Pillar of Celestial Fire. 1st World Publishing. p. 260. ISBN 1-887472-30-4.
- ↑ "Mercury and the environment — Basic facts". Environment Canada, Federal Government of Canada. 2004. Archived from the original on 16 సెప్టెంబరు 2011. Retrieved 1 ఏప్రిల్ 2018.
- ↑ "Mercury — Element of the ancients". Center for Environmental Health Sciences, Dartmouth College. Archived from the original on 2 డిసెంబరు 2012. Retrieved 1 ఏప్రిల్ 2018.
- ↑ "Qin Shihuang". Ministry of Culture, People's Republic of China. 2003. Archived from the original on 4 జూలై 2008. Retrieved 1 ఏప్రిల్ 2018.
- ↑ Wright, David Curtis (2001). The History of China. Greenwood Publishing Group. p. 49. ISBN 0-313-30940-X.
- ↑ Sobernheim, Moritz (1987). "Khumārawaih". In Houtsma, Martijn Theodoor (ed.). E.J. Brill's first encyclopaedia of Islam, 1913–1936, Volume IV: 'Itk–Kwaṭṭa. Leiden: BRILL. p. 973. ISBN 90-04-08265-4. Archived from the original on 3 జూన్ 2016.
- ↑ Yuhas, Alan (24 ఏప్రిల్ 2015). "Liquid mercury found under Mexican pyramid could lead to king's tomb". The Guardian (in బ్రిటిష్ ఇంగ్లీష్). ISSN 0261-3077. Archived from the original on 1 డిసెంబరు 2016. Retrieved 22 నవంబరు 2016.
- ↑ Pendergast, David M. (6 August 1982). "Ancient maya mercury". Science. 217 (4559): 533–535. Bibcode:1982Sci...217..533P. doi:10.1126/science.217.4559.533. PMID 17820542.
- ↑ "Lamanai". Archived from the original on 11 జూన్ 2011. Retrieved 1 ఏప్రిల్ 2018.
- ↑ Hesse R W (2007). Jewelrymaking through history. Greenwood Publishing Group. p. 120. ISBN 0-313-33507-9.
- ↑ Stillman, J. M. (2003). Story of Alchemy and Early Chemistry. Kessinger Publishing. pp. 7–9. ISBN 978-0-7661-3230-6.
- ↑ Eisler, R. (2006). Mercury hazards to living organisms. CRC Press. ISBN 978-0-8493-9212-2.
- ↑ Ehrlich, H. L.; Newman D. K. (2008). Geomicrobiology. CRC Press. p. 265. ISBN 978-0-8493-7906-2.
- ↑ Rytuba, James J. "Mercury from mineral deposits and potential environmental impact". Environmental Geology. 43 (3): 326–338. doi:10.1007/s00254-002-0629-5.
- ↑ "Mercury Recycling in the United States in 2000" (PDF). USGS. Archived (PDF) from the original on 26 మార్చి 2009. Retrieved 7 జూలై 2009.
- ↑ Burkholder, M.; Johnson, L. (2008). Colonial Latin America. Oxford University Press. pp. 157–159. ISBN 0-19-504542-4.
- ↑ Jamieson, R W (2000). Domestic Architecture and Power. Springer. p. 33. ISBN 0-306-46176-5.
- ↑ Brooks, W. E. (2007). "Mercury" (PDF). U.S. Geological Survey. Archived (PDF) from the original on 27 మే 2008. Retrieved 30 మే 2008.
- ↑ World Mineral Production. London: British Geological Survey, NERC. 2007.
- ↑ About the Mercury Rule Archived 1 మే 2012 at the Wayback Machine. Act.credoaction.com (21 December 2011). Retrieved on 30 December 2012.
- ↑ 35.0 35.1 Sheridan, M. (3 మే 2009). "'Green' Lightbulbs Poison Workers: hundreds of factory staff are being made ill by mercury used in bulbs destined for the West". The Sunday Times (of London, UK). Archived from the original on 17 మే 2009. Retrieved 1 ఏప్రిల్ 2018.
- ↑ Henderson, W. (2000). Main group chemistry. Great Britain: Royal Society of Chemistry. p. 162. ISBN 0-85404-617-8. Archived from the original on 13 మే 2016.
- ↑ Brown, I. D.; Gillespie, R. J.; Morgan, K. R.; Tun, Z.; Ummat, P. K. (1984). "Preparation and crystal structure of mercury hexafluoroniobate (Hg
3NbF
6) and mercury hexafluorotantalate (Hg
3TaF
6): mercury layer compounds". Inorganic Chemistry. 23 (26): 4506–4508. doi:10.1021/ic00194a020. - ↑ Rogalski, A (2000). Infrared detectors. CRC Press. p. 507. ISBN 90-5699-203-1.
- ↑ Surmann, P; Zeyat, H (November 2005). "Voltammetric analysis using a self-renewable non-mercury electrode". Analytical and Bioanalytical Chemistry. 383 (6): 1009–13. doi:10.1007/s00216-005-0069-7. PMID 16228199.
- ↑ FDA. "Thimerosal in Vaccines". Archived from the original on 26 అక్టోబరు 2006. Retrieved 25 అక్టోబరు 2006.
- ↑ Parker SK; Schwartz B; Todd J; Pickering LK (2004). "Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data". Pediatrics. 114 (3): 793–804. doi:10.1542/peds.2004-0434. PMID 15342856. Erratum Archived 13 ఆగస్టు 2007 at the Wayback Machine (2005). Pediatrics 115 (1): 200. doi:10.1542/peds.2004-2402 PMID 15630018.
- ↑ "Thimerosal in vaccines". Center for Biologics Evaluation and Research, U.S. Food and Drug Administration. 6 సెప్టెంబరు 2007. Archived from the original on 29 సెప్టెంబరు 2007. Retrieved 1 అక్టోబరు 2007.
- ↑ Liu J; Shi JZ; Yu LM; Goyer RA; Waalkes MP (2008). "Mercury in traditional medicines: is cinnabar toxicologically similar to common mercurials?". Exp. Biol. Med. (Maywood). 233 (7): 810–7. doi:10.3181/0712-MR-336. PMC 2755212. PMID 18445765.
- ↑ "Two States Pass First-time Bans on Mercury Blood Pressure Devices". Health Care Without Harm. 2 జూన్ 2003. Archived from the original on 4 అక్టోబరు 2011. Retrieved 1 ఏప్రిల్ 2018.
- ↑ "Title 21—Food and Drugs Chapter I—Food and Drug Administration Department of Health and Human Services Subchapter D—Drugs for Human Use Code of federal regulations". United States Food and Drug Administration. Archived from the original on 13 మార్చి 2007. Retrieved 1 ఏప్రిల్ 2018.
- ↑ "Mercury Reduction Act of 2003". United States. Congress. Senate. Committee on Environment and Public Works. Retrieved 6 June 2009.
- ↑ "Liquid-mirror telescope set to give stargazing a new spin". Govert Schilling. 14 March 2003. Archived from the original on 18 August 2003. Retrieved 11 October 2008.
- ↑ Gibson, B. K. (1991). "Liquid Mirror Telescopes: History". Journal of the Royal Astronomical Society of Canada. 85: 158. Bibcode:1991JRASC..85..158G.
- ↑ "Laval University Liquid mirrors and adaptive optics group". Archived from the original on 18 సెప్టెంబరు 2011. Retrieved 1 ఏప్రిల్ 2018.
- ↑ Hopkinson, G. R.; Goodman, T. M.; Prince, S. R. (2004). A guide to the use and calibration of detector array equipment. SPIE Press. p. 125. ISBN 0-8194-5532-6.
- ↑ "Mercury: Spills, Disposal and Site Cleanup". Environmental Protection Agency. Archived from the original on 13 మే 2008. Retrieved 11 ఆగస్టు 2007.
- ↑ "Minamata Convention Agreed by Nations". United Nations Environment Program. Archived from the original on 30 జనవరి 2013. Retrieved 19 జనవరి 2013.
- ↑ Section, United Nations News Service (19 జనవరి 2013). "UN News — Governments at UN forum agree on legally-binding treaty to curb mercury pollution". UN News Service Section. Archived from the original on 16 అక్టోబరు 2016. Retrieved 22 నవంబరు 2016.
- ↑ "Mercury: Laws and regulations". United States Environmental Protection Agency. 16 ఏప్రిల్ 2008. Archived from the original on 13 మే 2008. Retrieved 30 మే 2008.
- ↑ "Reductions in Mercury Emissions". International Joint Commission on the Great Lakes. Archived from the original on 28 ఆగస్టు 2008. Retrieved 1 ఏప్రిల్ 2018.
- ↑ "Directive 2002/95/EC on the Restriction of the Use of Certain Hazardous Substances in Electrical and Electronic Equipment". 27 January 2003. Archived from the original on 22 డిసెంబరు 2008. Retrieved 1 ఏప్రిల్ 2018. Article 4 Paragraph 1. e.g. "Member States shall ensure that, from July 1, 2006, new electrical and electronic equipment put on the market does not contain lead, mercury, cadmium, hexavalent chromium, polybrominated biphenyls (PBB) or polybrominated diphenyl ethers (PBDE)."
- ↑ "Mercury compounds in European Union:". EIA Track. 2007. Archived from the original on 28 ఏప్రిల్ 2008. Retrieved 1 ఏప్రిల్ 2018.
- ↑ Jones H. (10 జూలై 2007). "EU bans mercury in barometers, thermometers". Reuters. Archived from the original on 3 జనవరి 2009. Retrieved 12 సెప్టెంబరు 2017.
- ↑ "Norway to ban mercury". EU Business. 21 December 2007. Archived from the original on 21 January 2008. Retrieved 30 May 2008.
- ↑ Berg, T; Fjeld, E; Steinnes, E (2006). "Atmospheric mercury in Norway: contributions from different sources". The Science of the total environment. 368 (1): 3–9. doi:10.1016/j.scitotenv.2005.09.059. PMID 16310836.
- ↑ 61.0 61.1 Edlich, Richard F.; Rhoads, Samantha K.; Cantrell, Holly S.; Azavedo, Sabrina M. and Newkirk, Anthony T. Banning Mercury Amalgam Archived 1 నవంబరు 2013 at the Wayback Machine. US FDA
- ↑ "Sweden to ban mercury — The Local". 14 January 2009. Archived from the original on 28 August 2016. Retrieved 22 November 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ↑ "Sweden may be forced to lift ban on mercury — The Local". 21 April 2012. Archived from the original on 28 August 2016. Retrieved 22 November 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link)
ఇతర పఠనాలు
[మార్చు]- Andrew Scott Johnston, Mercury and the Making of California: Mining, Landscape, and Race, 1840–1890. Boulder, CO: University Press of Colorado, 2013.
బయటి లింకులు
[మార్చు]- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Mercury
- Mercury at The Periodic Table of Videos (University of Nottingham)
- Centers for Disease Control and Prevention – Mercury Topic
- EPA fish consumption guidelines
- Hg 80 Mercury
- Material Safety Data Sheet – Mercury
- Stopping Pollution: Mercury – Oceana
- Natural Resources Defense Council (NRDC): Mercury Contamination in Fish guide Archived 2008-07-06 at the Wayback Machine – NRDC
- NLM Hazardous Substances Databank – Mercury
- BBC – Earth News – Mercury 'turns' wetland birds such as ibises homosexual
- Changing Patterns in the Use, Recycling, and Material Substitution of Mercury in the United States United States Geological Survey
- Thermodynamical data on liquid mercury.
- . ఎన్సైక్లోపీడియా బ్రిటానికా (in ఇంగ్లీష్) (11th ed.). 1911.





