జెర్మేనియం
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| జెర్మేనియం | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | /dʒɜːrˈmeɪniəm/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | grayish-white | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ge) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| జెర్మేనియం in the periodic table | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | మూస:Infobox element/symbol-to-group/format | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d10 4s2 4p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1211.40 K (938.25 °C, 1720.85 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3106 K (2833 °C, 5131 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 5.323 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 5.60 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 36.94 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 334 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 23.222 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −3, −2, −1, 0,[3] +1, +2, +3, +4 (an amphoteric oxide) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.01 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 122 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 122 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 211 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered diamond-cubic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 5400 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 6.0 µm/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 60.2 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 1 Ω⋅m (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Band gap | 0.67 eV (at 300 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −76.84×10−6 cm3/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young's modulus | 103 GPa[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 41 GPa[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 75 GPa[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.26[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 6.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-56-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | జర్మనీ దేశం పేరు మీద | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prediction | మెండలియెవ్ (1869) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | క్లెమెన్స్ వింక్లర్ (1886) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes of జెర్మేనియం | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Template:infobox జెర్మేనియం isotopes does not exist | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
జెర్మేనియం (Ge) పరమాణు సంఖ్య 32 కలిగిన రసాయన మూలకం. ఇది కార్బన్ గ్రూపులో ఉన్న, మెరిసే బూడిద-తెలుపు రంగులో ఉండే, గట్టి-పెళుసైన అర్ధ లోహం (మెటలాయిడ్).[గమనికలు 1] రసాయనికంగా ఇది దాని పొరుగున ఉన్న సిలికాన్, టిన్లను పోలి ఉంటుంది. స్వచ్ఛమైన జెర్మేనియం, సిలికాన్ మూలకంతో సమానమైన రూపాన్ని కలిగి ఉంటుంది. ఇది పరోక్ష సెమీకండక్టర్. సిలికాన్ వలె, జెర్మేనియం సహజంగా ప్రతిస్పందిస్తుంది, ప్రకృతిలో ఆక్సిజన్తో సముదాయాలను ఏర్పరుస్తుంది.
ఇది అధిక సాంద్రతల్లో చాలా అరుదుగా కనిపిస్తుంది కాబట్టి, జెర్మేనియం రసాయన శాస్త్ర చరిత్రలో ఆలస్యంగా కనుగొన్నారు. జెర్మేనియం భూమి పెంకు లోని మూలకాల సాపేక్ష సమృద్ధిలో యాభయ్యవ స్థానంలో ఉంది. 1869లో, డిమిత్రి మెండలీవ్ తన ఆవర్తన పట్టికలో దాని స్థానాన్ని, దాని కొన్ని లక్షణాలనూ అంచనా వేశాడు. ఈ మూలకాన్ని అతను ఎకాసిలికాన్ అని పిలిచాడు. దాదాపు రెండు దశాబ్దాల తర్వాత, 1886లో, క్లెమెన్స్ వింక్లర్, ఆర్గిరోడైట్ అనే అసాధారణ ఖనిజంలో వెండి, సల్ఫర్లతో పాటు ఓ కొత్త మూలకాన్ని కనుగొన్నాడు. కొత్త మూలకం చూడడానికి కొంతవరకు ఆర్సెనిక్, యాంటిమోనీని పోలి ఉన్నప్పటికీ, సమ్మేళనాలలో ఉన్న నిష్పత్తులను బట్టి, సిలికాన్ బంధువు అని మెండలీవ్ వేసిన అంచనాలకు సరిపోయింది. వింక్లర్ ఆ మూలకానికి తన దేశం జర్మనీ పేరు పెట్టాడు. నేడు, జెర్మేనియం ప్రధానంగా స్ఫాలరైట్ (జింక్ యొక్క ప్రాధమిక ధాతువు) నుండి తవ్వబడుతుంది. అయితే జెర్మేనియం వెండి, సీసం, రాగి ఖనిజాల నుండి వాణిజ్యపరంగా లభిస్తోంది.
మూలక జెర్మేనియంను ట్రాన్సిస్టర్లు వంటి అనేక ఎలక్ట్రానిక్ పరికరాలలో సెమీకండక్టర్గా ఉపయోగిస్తారు. చారిత్రికంగా, సెమీకండక్టర్ ఎలక్ట్రానిక్స్ యొక్క మొదటి దశాబ్దం పూర్తిగా జెర్మేనియం పైనే ఆధారపడింది. ప్రస్తుతం, ఫైబర్-ఆప్టిక్ సిస్టమ్స్, ఇన్ఫ్రారెడ్ ఆప్టిక్స్, సోలార్ సెల్ అప్లికేషన్లు, లైట్-ఎమిటింగ్ డయోడ్లు (LEDలు) దీని ప్రధాన ఉపయోగాలు. జెర్మేనియం సమ్మేళనాలను పాలిమరైజేషన్ ఉత్ప్రేరకాల్లో కూడా ఉపయోగిస్తారు. ఇటీవల నానోవైర్ల ఉత్పత్తిలో కూడా ఉపయోగించారు. ఈ మూలకం ఆర్గానోమెటాలిక్ కెమిస్ట్రీలో ఉపయోగపడే టెట్రాఇథైల్జెర్మేనియం వంటి ఆర్గానోజెర్మేనియం సమ్మేళనాలను పెద్ద సంఖ్యలో ఏర్పరుస్తుంది. జెర్మేనియంను కీలకమైన సాంకేతికత అంశంగా పరిగణిస్తారు. [7]
జెర్మేనియం జీవికి అవసరమైన మూలకం కాదు. కొన్ని సంక్లిష్టమైన సేంద్రీయ జెర్మేనియం సమ్మేళనాలనుఔషధాలుగా వాడవచ్చునా అనేది పరిశోధించబడుతోంది. అయితే అవి ఇంకా విజయవంతం కాలేదు. సిలికాన్, అల్యూమినియంల మాదిరిగానే, సహజంగా సంభవించే జెర్మేనియం సమ్మేళనాలు నీటిలో కరగవు. అందువల్ల అవి నోటికి విషపూరితం కావు. అయితే, కరిగే జెర్మేనియం సింథటిక్ లవణాలు నెఫ్రోటాక్సిక్గా ఉంటాయి. హాలోజన్లు, హైడ్రోజన్తో కూడిన సింథటిక్ రసాయనికంగా రియాక్టివ్ జెర్మేనియం సమ్మేళనాలు చికాకు కలిగిస్తాయి.
లక్షణాలు
[మార్చు]ప్రామాణిక పరిస్థితులలో, జెర్మేనియం పెళుసుగా, వెండి-తెలుపు రంగులో ఉండే, సెమీ మెటాలిక్ మూలకం. ఈ రూపం α-జెర్మేనియం అని పిలువబడే ఒక అలోట్రోప్ను కలిగి ఉంటుంది. ఇది వజ్రం లాగానే డైమండ్ క్యూబిక్ క్రిస్టల్ నిర్మాణాన్ని కలిగి ఉంటుంది. క్రిస్టల్ రూపంలో ఉన్నప్పుడు, జెర్మేనియం స్థానభ్రంశం థ్రెషోల్డ్ శక్తి . 120 kbar కంటే ఎక్కువ పీడనం వద్ద జెర్మేనియం, β- టిన్ ను పోలిన నిర్మాణంతో అలోట్రోప్ β- జెర్మేనియం అవుతుంది. సిలికాన్, గాలియం, బిస్మత్, యాంటీమోనీ, నీరు లాగా జెర్మేనియం కూడా ద్రవ స్థితి నుండి ఘనీభవించినప్పుడు వ్యాకోచిస్తుంది. [8]
జెర్మేనియం ఒక సెమీకండక్టర్. సెమీకండక్టర్ల కోసం జోన్ రిఫైనింగ్ పద్ధతులు స్ఫటికాకార జెర్మేనియం ఉత్పత్తికి దారితీశాయి. ఇందులో 1010 లో ఒక భాగం మాత్రమే మలినం ఉంటుంది, [9] ఇప్పటివరకు అందుబాటులో ఉన్న అత్యంత స్వచ్ఛమైన పదార్థాలలో ఇది ఒకటి. అత్యంత బలమైన విద్యుదయస్కాంత క్షేత్రం సమక్షంలో సూపర్ కండక్టర్గా మారుతాయని (2005లో) కనుగొన్న మొదటి లోహ పదార్థం - జెర్మేనియం, యురేనియం, రోడియంల మిశ్రమం.
రసాయన ధర్మాలు
[మార్చు]మూలక జెర్మేనియం 250 °C, వద్ద గాలిలో నెమ్మదిగా ఆక్సీకరణం చెందడం మొదలై GeO2 ను ఏర్పరుస్తుంది. జెర్మేనియం పలుచని ఆమ్లాలు, క్షారాలలో కరగదు కానీ వేడి, గాఢ సల్ఫ్యూరిక్, నైట్రిక్ ఆమ్లాలలో నెమ్మదిగా కరిగిపోతుంది. కరిగిన ఆల్కాలిస్తో హింసాత్మకంగా చర్య జరిపి జెర్మేనేట్లను ( [GeO
3]2−
) ఉత్పత్తి చేస్తుంది. అనేక +2 సమ్మేళనాలు తెలిసినప్పటికీ జెర్మేనియం ఎక్కువగా ఆక్సీకరణ స్థితి +4లో సంభవిస్తుంది. [10] ఇతర ఆక్సీకరణ స్థితులు చాలా అరుదు: Ge2Cl6 వంటి సమ్మేళనాలలో +3 కనుగొనబడింది. ఆక్సైడ్ల ఉపరితలంపై +3, +1 కనిపిస్తాయి. Mg
2Ge లో −4 వంటి జెర్మానైడ్లలో ప్రతికూల ఆక్సీకరణ స్థితులు కనిపిస్తాయి. జెర్మేనియం క్లస్టర్ అయాన్లు ( Zintl అయాన్లు) Ge42−, Ge94−, Ge92−, [(Ge9)2]6− క్షార లోహాలు, ద్రవ అమ్మోనియాలోని జెర్మేనియం మిశ్రమాల నుండి వెలికితీత ద్వారా తయారు చేయబడ్డాయి. [10] ఈ అయాన్లలోని మూలకం యొక్క ఆక్సీకరణ స్థితులు ఓజోనైడ్స్ O3- లాగా పూర్ణాంకాలు కావు.
ఐసోటోపులు
[మార్చు]జెర్మేనియం 5 సహజ ఐసోటోపులలో సంభవిస్తుంది. అవి: 70
Ge
, 72
Ge
, 73
Ge
, 74
Ge
, 76
Ge
. వీటిలో, 76
Ge
చాలా కొద్దిగా రేడియోధార్మికత, 1.78×1021 సంవత్సరాల అర్ధజీవితంతో డబుల్ బీటా క్షయం ద్వారా క్షీణిస్తుంది. 74
Ge
అత్యంత సాధారణ ఐసోటోపు. ఇది దాదాపు 36% సహజ సమృద్ధిని కలిగి ఉంటుంది. 76
Ge
దాదాపు 7% సహజ సమృద్ధితో అతి తక్కువ సమృద్ధి కలిగిన ఐసోటోపు. ఆల్ఫా కణాలతో తాకిడి చేసినప్పుడు, ఐసోటోప్ 72
Ge
స్థిరమైన 77
Se
ని ఉత్పత్తి చేస్తుంది. ఈ ప్రక్రియలో అధిక శక్తి ఎలక్ట్రాన్లను విడుదల చేస్తుంది. [11] దీని కారణంగా, దీన్ని అణు బ్యాటరీలలో రాడాన్తో కలిపి ఉపయోగిస్తారు. [11]
పరమాణు ద్రవ్యరాశి 58 నుండి 89 వరకు ఉన్న కనీసం 27 రేడియో ఐసోటోప్లు కూడా సంశ్లేషణ చేయబడ్డాయి ఉంటుంది. వీటిలో అత్యంత స్థిరమైనది 68
Ge
. ఇది 270.95 d అర్ధ జీవితంతో ఎలక్ట్రాన్ క్యాప్చర్ ద్వారా క్షీణిస్తుంది. కనిష్ట స్థిరత్వం కలిగినది 60
Ge
. దీని అర్ధ జీవితం 30 ms. జెర్మేనియం యొక్క చాలా రేడియో ఐసోటోప్లు బీటా క్షయం ద్వారా క్షీణిస్తాయి, 61
Ge
, 64
Ge
లు Error no symbol defined ప్రోటాన్ ఉద్గారం ద్వారా క్షయం చెందుతాయి. 84
Ge
నుండి 87
Ge
వరకు ఉన్న ఐసోటోప్లు కూడా స్వల్ప Error no symbol defined ప్రోటాన్ ఉద్గారాన్ని ప్రదర్శిస్తాయి [12]
లభ్యత
[మార్చు]
జెర్మేనియం నక్షత్రాల్లో జరిగే న్యూక్లియోసింథసిస్ ద్వారా - ఎక్కువగా అసిమ్ప్టోటిక్ జెయింట్ బ్రాంచ్ స్టార్లలో s-ప్రక్రియ ద్వారా - తయారవుతుంది. s-ప్రక్రియ అనేది ఎర్ర జెయింట్ నక్షత్రాల లోపల తేలికైన మూలకాల నుండి నెమ్మదిగా జరిగే న్యూట్రాన్ సంగ్రహణ. జెర్మేనియంను చాలా సుదూర నక్షత్రాల లోను, బృహస్పతి వాతావరణం లోనూ కనుగొన్నారు.
భూమి పెంకులో జెర్మేనియం సమృద్ధి సుమారు 1.6 ppm ఆర్గిరోడైట్, బ్రియార్టైట్, జెర్మేనైట్, రెనియరైట్, స్ఫాలరైట్ వంటి కొన్ని ఖనిజాల్లో మాత్రమే జెర్మేనియం గణనీయమైన మొత్తాల్లో ఉంటుంది. వాటిలో కొన్నిటిలో మాత్రమే (ముఖ్యంగా జెర్మేనైట్) చాలా అరుదుగా, వెలికి తీయదగిన మొత్తంలో కనిపిస్తుంది. [13] [14] కొన్ని జింక్-కాపర్-లీడ్ ధాతువుల్లో మాత్రమే వెలికితీయడానికి తగినంత జెర్మేనియం ఉంటుంది. [15] కొన్ని బొగ్గు పొరల్లో అసాధారణంగా జరిగే సహజ సుసంపన్నత ప్రక్రియ కారణంగా జెర్మేనియం పాళ్ళు అధికంగా ఉంటుంది. అత్యధిక సాంద్రత గల హార్ట్లీ బొగ్గు బూడిదలో 1.6% జెర్మేనియం ఉంది. [16] [17] ఇన్నర్ మంగోలియాలోని జిలిన్హాట్ సమీపంలోని బొగ్గు నిక్షేపాల్లో 1600 టన్నుల జెర్మేనియం ఉన్నట్లు అంచనా. [15]
ఉత్పత్తి
[మార్చు]2011లో ప్రపంచవ్యాప్తంగా సుమారు 118 టన్నుల జెర్మేనియం ఉత్పత్తి అయింది. ఎక్కువగా చైనా (80 టన్నులు), రష్యా (5 టన్నులు) యునైటెడ్ స్టేట్స్ (3 టన్నులు). [18] జెర్మేనియం స్ఫాలరైట్ జింక్ ఖనిజాల నుండి ఉప-ఉత్పత్తిగా వస్తుంది. ఇక్కడ అది 0.3% వరకూ కేంద్రీకృతమై ఉంటుంది, [19] [20] ఇటీవలి అధ్యయనంలో జింక్ నిల్వలలో కనీసం 10,000 t వెలికితీయగల జెర్మేనియం ఉందని కనుగొన్నారు. బొగ్గు నిల్వలలో కనీసం 1,12,000 t ఉన్నట్లు కనుగొన్నారు. [21] [22] 2007లో 35% జెర్మేనియం డిమాండు రీసైకిలింగు ద్వారా తీర్చబడింది. [15]
ఉపయోగాలు
[మార్చు]2007లో ప్రపంచవ్యాప్తంగా జెర్మేనియం యొక్క ప్రధాన ఉపయోగాలు ఇలా ఉన్నట్లు అంచనా వేసారు: 35% ఫైబర్-ఆప్టిక్స్, 30% ఇన్ఫ్రారెడ్ ఆప్టిక్స్, 15% పాలిమరైజేషన్ ఉత్ప్రేరకాలు, 15% ఎలక్ట్రానిక్స్, సోలార్ ఎలక్ట్రిక్ అప్లికేషన్లు. [23] మిగిలిన 5% ఫాస్ఫార్లు, మెటలర్జీ, కీమోథెరపీ వంటి రంగాల్లో ఉపయోగించారు. [24]
ఆప్టిక్స్
[మార్చు]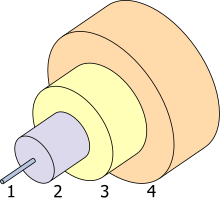
- కోర్ 8 µm
- క్లాడింగు 125 µm
- బఫర్ 250 µm
- జాకెట్ 400 µm
అధిక వక్రీభవన సూచిక, తక్కువ ఆప్టికల్ వ్యాప్తి లు జెర్మేనియా (GeO 2) యొక్క గుర్తించదగిన లక్షణాలు. ఇవి వైడ్ యాంగిల్ కెమెరా లెన్స్లు, మైక్రోస్కోపీ, ఆప్టికల్ ఫైబర్స్ యొక్క ప్రధాన భాగానికి ప్రత్యేకంగా ఉపయోగపడతాయి. [25] [26] సిలికా ఫైబర్ కోసం డోపాంట్గా టైటానియా స్థానంలో దీన్ని వాడతారు. దీనివలన ఫైబర్లను పెళుసుగా మార్చే ఉష్ణ క్రియ అవసరం ఉండదు. [27] 2002 చివరి నాటికి, యునైటెడ్ స్టేట్స్లో వార్షిక జెర్మేనియం వినియోగంలో ఫైబర్ ఆప్టిక్స్ పరిశ్రమ 60% వినియోగించింది. అయితే ఇది ప్రపంచవ్యాప్త వినియోగంలో 10% కంటే తక్కువ. [26] GeSbTe అనేది దాని ఆప్టిక్ లక్షణాల కోసం ఉపయోగించే దశ మార్పు పదార్థం. మళ్ళీ మళ్ళీ వ్రాయదగిన DVD లలో దీన్ని ఉపయోగిస్తారు. [28]
ఎలక్ట్రానిక్స్
[మార్చు]సిలికాన్-జెర్మేనియం మిశ్రమాలు హై-స్పీడ్ ఇంటిగ్రేటెడ్ సర్క్యూట్లకు ముఖ్యమైన సెమీకండక్టర్ మెటీరియల్గా మారుతున్నాయి. Si-SiGe హెటెరోజక్షన్ల లక్షణాలను ఉపయోగించుకునే సర్క్యూట్లు సిలికాన్ను మాత్రమే ఉపయోగించే వాటి కంటే చాలా వేగంగా ఉంటాయి. [29] వైర్లెస్ కమ్యూనికేషన్ పరికరాలలో గాలియం ఆర్సెనైడ్ (GaAs) స్థానంలో సిలికాన్-జెర్మేనియం వాడుక ఎక్కువౌతోంది. [30] అధిక-వేగ లక్షణాలున్న SiGe చిప్లను తక్కువ-ధరలో, బాగా అలవాటైన ఉత్పత్తి సాంకేతికతలతో తయారు చేస్తున్నారు. [31]
అధిక సామర్థ్యం గల సోలార్ ప్యానెల్స్ జెర్మేనియం యొక్క ప్రధాన ఉపయోగం. జెర్మేనియం, గాలియం ఆర్సెనైడ్ దాదాపు ఒకే విధమైన లాటిస్ స్థిరాంకం కలిగి ఉన్నందున, జెర్మేనియం సబ్స్ట్రేట్లను గాలియం-ఆర్సెనైడ్ సౌర ఘటాలను తయారు చేయడానికి ఉపయోగించవచ్చు. ట్రిపుల్-జంక్షన్ గాలియం ఆర్సెనైడ్ని ఉపయోగించే మార్స్ ఎక్స్ప్లోరేషన్ రోవర్స్ వంటి అంతరిక్ష అనువర్తనాలలో జెర్మేనియంను వాడవచ్చు. ఆటోమొబైల్ హెడ్లైట్ల కోసం, LCD స్క్రీన్లను బ్యాక్లైట్ చేయడానికి ఉపయోగించే అధిక-ప్రకాశవంతమైన LEDలు కూడా ఒక ముఖ్యమైన అప్లికేషన్.
ఇతర ఉపయోగాలు
[మార్చు]పాలిథిలిన్ టెరెఫ్తాలేట్ (PET) ఉత్పత్తిలో పాలిమరైజేషన్ కోసం జెర్మేనియం డయాక్సైడ్ను ఉత్ప్రేరకాలుగా కూడా వాడతారు. ఈ పాలిస్టర్ను జపాన్లో విక్రయించబడే PET బాటిళ్లకు ప్రత్యేకంగా అనుకూలంగా ఉంటుంది. [32] యునైటెడ్ స్టేట్స్లో, పాలిమరైజేషన్ ఉత్ప్రేరకాలు కోసం జెర్మేనియంను ఉపయోగించరు.
సిలికా (SiO2) జెర్మేనియం డయాక్సైడ్ (GeO2) ల మధ్య గల సారూప్యత కారణంగా, కొన్ని గ్యాస్ క్రోమాటోగ్రఫీ నిలువు వరుసలలోని సిలికా స్థిరమైన దశ స్థానంలో GeO2 ను వాడవచ్చు.
ఇటీవలి సంవత్సరాలలో విలువైన లోహ మిశ్రమాలలో జెర్మేనియం వినియోగం పెరుగుతోంది. ఉదాహరణకు, స్టెర్లింగ్ వెండి మిశ్రమాలలో ఇది ఫైర్స్కేల్ను తగ్గిస్తుంది, టార్నిష్ నిరోధకతను పెంచుతుంది. అవక్షేపం గట్టిపడడాన్ని మెరుగుపరుస్తుంది. ట్రేడ్మార్క్ చేయబడిన అర్జెంటీయంలో 1.2% జెర్మేనియం ఉంటుంది. [33]
స్పింట్రోనిక్స్ లోను, స్పిన్-ఆధారిత క్వాంటం కంప్యూటింగ్ అప్లికేషన్ల లోనూ వాడే ముఖ్యమైన పదార్థంగా జెర్మేనియం అభివృద్ధి చెందుతోంది. 2010లో, పరిశోధకులు గది ఉష్ణోగ్రత వద్ద స్పిన్ రవాణాను ప్రదర్శించారు.
జెర్మేనియం, ఆరోగ్యం
[మార్చు]జెర్మేనియంను మొక్కలు లేదా జంతువుల ఆరోగ్యానికి అవసరమైనదిగా పరిగణించరు. [34] వాతావరణంలో జెర్మేనియం ఆరోగ్యంపై ఎటువంటి ప్రభావం చూపదు. ఇది సాధారణంగా ఖనిజాలు, కర్బన పదార్థాలలో ట్రేస్ ఎలిమెంట్గా మాత్రమే ఉంటుంది. వివిధ పారిశ్రామిక, ఎలక్ట్రానిక్ అప్లికేషన్లలో ఇది చాలా చిన్న పరిమాణాల్లోనే ఉంటుంది. [35] ఇలాంటి కారణాల వల్ల, అంతిమ వినియోగ జెర్మేనియం పర్యావరణంపై తక్కువ ప్రభావాన్ని చూపుతుంది. జెర్మేనియం యొక్క కొన్ని రియాక్టివ్ ఇంటర్మీడియట్ సమ్మేళనాలు విషపూరితమైనవి. [36]
జాగ్రత్తలు
[మార్చు]జెర్మేనియం వాడకానికి జాగ్రత్తలు అవసరం లేనప్పటికీ, జెర్మేనియం నుండి కృత్రిమంగా ఉత్పత్తి చేయబడిన కొన్ని సమ్మేళనాలు చాలా రియాక్టివ్గా ఉంటాయి. మానవ ఆరోగ్యానికి తక్షణ ప్రమాదాన్ని కలిగిస్తాయి. ఉదాహరణకు, జెర్మేనియం క్లోరైడ్, జెర్మేన్ (GeH4) ఒకటి ద్రవం రేండోది వాయువు. ఇవి కళ్ళు, చర్మం, ఊపిరితిత్తులు, గొంతుకు చాలా చికాకు కలిగిస్తాయి. [37]
గమనికలు
[మార్చు]- ↑ లోహాలు, అలోహాల లక్షణాలకు మధ్య ఉండే, లేదా ఆ రెండింటి లక్షణాలను కలిగి ఉండే మూలకం. దీనికి ప్రామాణికమైన నిర్వచనం అంటూ లేదు. ఏ మూలకాలు అర్ధ లోహాలు అనే విషయమై పూర్తి సమ్మతి, స్పష్టత కూడా లేదు. స్పష్టత లేనప్పటికీ, ఈ పదం రసాయన శాస్త్రంలో వాడుకలో ఉంది.
మూలాలు
[మార్చు]- ↑ "Standard Atomic Weights: Germanium". CIAAW. 2009.
- ↑ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; et al. (2022-05-04). "Standard atomic weights of the elements 2021 (IUPAC Technical Report)". Pure and Applied Chemistry (in ఇంగ్లీష్). doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ↑ "New Type of Zero-Valent Tin Compound". Chemistry Europe. 27 August 2016.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ↑ 6.0 6.1 6.2 6.3 "Properties of Germanium". Ioffe Institute.
- ↑ (June 2019). "Critical Metals Ga, Ge and In: Experimental Evidence for Smelter Recovery Improvements".
- ↑ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (102nd ed.). de Gruyter. ISBN 978-3-11-017770-1. OCLC 145623740.
- ↑ "Germanium". Los Alamos National Laboratory. Archived from the original on 2011-06-22. Retrieved 2008-08-28.
- ↑ 10.0 10.1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ 11.0 11.1 Perreault, Bruce A. "Alpha Fusion Electrical Energy Valve", US Patent 7800286, issued September 21, 2010.
- ↑ మూస:NUBASE 2003
- ↑ "Archived copy" (PDF). Archived (PDF) from the original on 2018-10-06. Retrieved 2018-10-06.
{{cite web}}: CS1 maint: archived copy as title (link) - ↑ "Archived copy" (PDF). Archived (PDF) from the original on 2020-03-20. Retrieved 2018-10-06.
{{cite web}}: CS1 maint: archived copy as title (link) - ↑ 15.0 15.1 15.2 Höll. "Metallogenesis of germanium – A review".
- ↑ Goldschmidt, V. M. (1930). "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. Archived from the original on 2018-03-03. Retrieved 2008-08-25.
- ↑ Goldschmidt, V. M.; Peters, Cl. (1933). "Zur Geochemie des Germaniums". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. Archived from the original on 2008-12-01. Retrieved 2008-08-25.
- ↑ U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. Archived from the original on 2008-09-16. Retrieved 2008-08-28.
Select 2008
- ↑ Bernstein, L. "Germanium geochemistry and mineralogy".
- ↑ Frenzel. "Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis".
- ↑ Frenzel. "On the geological availability of germanium".
- ↑ Frenzel. "Erratum to: On the geological availability of germanium".
- ↑ U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. Archived from the original on 2008-09-16. Retrieved 2008-08-28.
Select 2008
- ↑ U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. Archived from the original on 2008-09-16. Retrieved 2008-08-28.
Select 2008
- ↑ Rieke, G. H. (2007). "Infrared Detector Arrays for Astronomy".
- ↑ 26.0 26.1 Brown, Robert D. Jr. (2000). "Germanium" (PDF). U.S. Geological Survey. Archived (PDF) from the original on 2011-06-08. Retrieved 2008-09-22.
- ↑ "Chapter III: Optical Fiber For Communications" (PDF). Stanford Research Institute. Archived (PDF) from the original on 2014-12-05. Retrieved 2008-08-22.
- ↑ "Understanding Recordable & Rewritable DVD" (PDF) (First ed.). Optical Storage Technology Association (OSTA). Archived from the original (PDF) on 2009-04-19. Retrieved 2008-09-22.
- ↑ Washio, K. (2003). "SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems".
- ↑ U.S. Geological Survey. "Germanium – Statistics and Information".
- ↑ U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. Archived from the original on 2008-09-16. Retrieved 2008-08-28.
Select 2008
- ↑ Thiele, Ulrich K. (2001). "The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation". International Journal of Polymeric Materials. 50 (3): 387–394. doi:10.1080/00914030108035115. S2CID 98758568.
- ↑ U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. Archived from the original on 2008-09-16. Retrieved 2008-08-28.
Select 2008
- ↑ American Cancer Society Complete Guide to Complementary and Alternative Cancer Therapies. 2009.
- ↑ U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. Archived from the original on 2008-09-16. Retrieved 2008-08-28.
Select 2008
- ↑ Brown, Robert D. Jr. Commodity Survey:Germanium (PDF) (Report). US Geological Surveys. Retrieved 2008-09-09.
- ↑ Gerber, G. B. (1997). "Mutagenicity, carcinogenicity and teratogenicity of germanium compounds".



